某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):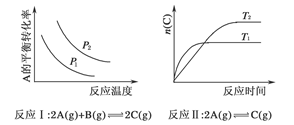
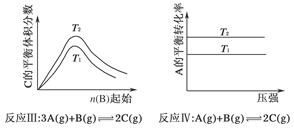
根据以上规律判断,下列结论正确的是( )
| A.反应Ⅰ:ΔH>0,p2>p1 |
| B.反应Ⅱ:ΔH<0,T1>T2 |
| C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 |
| D.反应Ⅳ:ΔH<0,T2>T1 |
简缩记忆法是学好化学的有效方法之一。下列有关实验,记忆简缩正确的是
①粉末状或细粒状固体的取用:一斜、二送、三直立
②块状固体或密度较大的大颗粒状固体的取用:一横、二放、三慢竖
③过滤的操作要点:一贴、二低、三靠
④气体的鉴别通常的步骤是:一看颜色、二闻气味、三用“火”试、四用试剂
| A.①②③④ | B.①②③ | C.①③④ | D.②③④ |
元素之间通过不同的化学键可以组成不同的晶体和化合物。有关化学键与晶体的说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.熔融状态时能导电的化合物一定是离子晶体 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.分子晶体的熔沸点随着共价键的增强而升高 |
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
| A.10Be和9Be是中子数不同质子数相同的不同原子 |
| B.10Be的原子核内中子数比质子数多 |
| C.5.2 g26Al3+中所含的电子数约为1.2×1024 |
| D.26Al和26Mg的质子数、中子数和核外电子数都不相同 |
完成下列实验,所选装置正确的是()
| A |
B |
C |
D |
|
| 实验 目的 |
检查装置气密性 |
实验室用纯碱和稀硫酸制备二氧化碳 |
用已知浓度的氢氧化钠溶液测定未知浓度盐酸 |
从碘的CCl4溶液中分离出碘 |
| 实验装置 |
 |
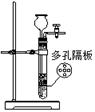 |
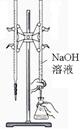 |
 |
固体电解质是通过离子迁移传递电荷。如RbAg4I5晶体,其中迁移的物种全是Ag+,利用RbAg4I5晶体,可以制成电化学气敏传感器,下图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。在气体传感器工作过程中,下列变化肯定没有发生的是()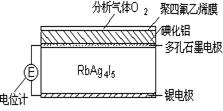
| A.Ag-e-=Ag+ | B.I2+2Ag++2e-=2AgI |
| C.I2+2Rb++2e-=2RbI | D.4AlI3+3O2=2Al2O3+6I2 |