实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸 mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶 ⑤250 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒 还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。 。
②如果加水超过了刻度线,取出水使液面恰好到刻度线。 。
③容量瓶没有干燥。
(10分)甲、乙两人分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸.
(1)甲:量取20 mL 18 mol/L浓硫酸,小心地倒入盛有少量水的烧瓶中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加入水至刻线定容,塞好瓶塞,反复上下颠倒摇匀.
①实验所用的玻璃仪器除烧杯和容量瓶外,还有__________________________。
②将溶液转移到容量瓶中的正确操作是________________________________。
③定容的正确操作是_________________________________________。
(2)乙:用100 mL量筒量取20 mL 18 mol/L浓硫酸,并向其中小心地加入少量水,搅拌均匀,等冷却至室温后,再加入水至100 mL刻线,再搅拌均匀.你认为此法是否正确?若不正确,指出其中错误之处_________。
(8分)下面a~f是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.托盘天平 d.温度计 e.分液漏斗
(1)标出仪器使用温度的是________(填写编号)。
(2)使用前需要检查是否漏水的是________(填写编号)。
(3)称取10.5 g固体样品(1 g以下使用游码)若样品与砝码错放位置,则实际称取的样品质量为________ g。
(4)配制2 mol·L-1 H2SO4时,用a量取浓H2SO4时视线高于液面,则配得的浓度(偏高、偏低或无影响)
如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: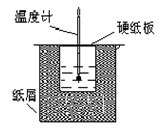
(1)从实验装置上看,图中伤缺少的一种玻璃仪器是_____________;
(2)烧杯间填满碎纸条的作用是____________________;
(3)若大烧杯上不盖硬纸板,求得的反应热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60 mL 0.50 mol·L-1HCl跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”)。
工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O==NH4HCO3,NH4HCO3+NaCl(饱和)==NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟实验这一过程,获得碳酸钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器旁自左至右分别用A、B、C……符号标明(请见题后说明)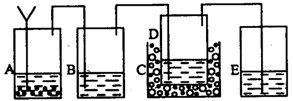
(1)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
A:__________________,B:___________________,C:__________________,
D:__________________,E_____________________。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶?
实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参加反应)。请回答下列问题: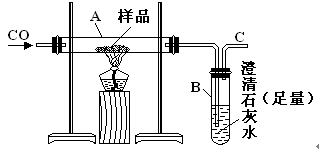
(1)该实验中炼铁的方法是填字母)。
| A.热分解法 | B.热还原法 | C.电解法 | D.湿法冶金 |
(2)实验开始后,B中的现象是。
A中有关反应的化学方程是。
(3)C处须进行尾气处理,其方法是。
(4)若样品的质量为3.6g,通入足量的CO充分反应后,B增重2.64g,则样品中铁的质量分数为(结果保留一位小数)。