下列对各种平衡体系的叙述中,完全正确的是一组是 ( )
①醋酸溶液中存在的电离平衡:CH3COOH CH3COO-+H+,加水稀释后,溶液中所有离子浓度均减小;
CH3COO-+H+,加水稀释后,溶液中所有离子浓度均减小;
②常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡逆向移动;
③某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s); △H>0平衡后,升高温度,该化学平衡正向移动;
2Z(g)+W(s); △H>0平衡后,升高温度,该化学平衡正向移动;
④在上述③的可逆反应中,当容器中气体压强不变时,反应达到平衡;
⑤一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO-+H2O CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
⑥在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动
⑦在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
| A.①②③④⑤ | B.②③④⑤⑥ | C.②③⑤⑥⑦ | D.①②⑤⑥⑦ |
关于CO2说法正确的是
| A.碳原子采取sp杂化 | B.CO2晶胞是体心结构 |
| C.干冰是原子晶体 | D.CO2为极性分子 |
已知含氧酸可用通式 (OH)nXOm来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是
| A.H2SeO3 | B.HMnO4 | C.H3BO3 | D.H3PO4 |
下面的排序不正确的是
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.熔点由高到低:Na>Mg>Al |
| C.硬度由大到小:金刚石>碳化硅>晶体硅 |
| D.晶格能由大到小: NaF> NaCl> NaBr>NaI |
现有四种晶体,其离子排列方式如图所示,其中化学式不属AB型的是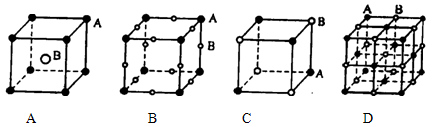
第3周期元素形成的单质中,属于原子晶体的是
| A.金刚砂 | B.金刚石 | C.单晶硅 | D.二氧化碳 |