以葡萄糖为燃料的微生物燃料电池结构示意图如图所示,关于该电池的叙述正确的是 ( )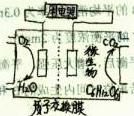
| A.该电池能够在高温下工作 |
| B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| C.放电过程中:H+从正极区向负极区迁移 |
| D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4/6L |
由2—氯丙烷为主要原料制1,2—丙二醇CH3CH(OH)CH2OH时,经过的反应为
| A.加成—消去—取代 | B.消去—加成—取代 |
| C.取代—消去—加成 | D.取代—加成—消去 |
约翰·芬恩(John fenn)等三位科学家因在蛋白质等大分子研究领域的杰出贡献获得了2002年的诺贝尔化学奖。下列有关说法正确的是
| A.蚕丝、羊毛、棉花的主要成分都是蛋白质 |
| B.蛋白质溶液不能产生丁达尔效应 |
| C.蛋白质溶液中加入CuSO4溶液产生盐析现象 |
| D.蛋白质在紫外线的照射下将失会去生理活性 |
汽车用乙醇汽油是把变性燃料乙醇和汽油按一定比例混配形成的一种新型汽车燃料。经多项检测结果表明,它不影响汽车的行驶性能,还可以减少有害气体的排放量。在美国、巴西等国早已推广使用。下列有关乙醇汽油的说法正确的是
| A.乙醇汽油是一种纯净物 |
| B.乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染 |
| C.乙醇和汽油都可作溶剂,也可相互溶解 |
| D.乙醇和乙二醇互为同系物 |
煤矿发生爆炸事故的元凶是坑道气中含有的甲烷。下列关于甲烷的叙述中错误的是
| A.甲烷分子是一种呈正四面体型的分子 |
| B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 |
| C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
| D.“抽”出坑道中的甲烷,既可防止爆炸,又可用作清洁燃料 |
一包氯化铵中混有一种其他氮肥,经测定这包不纯氯化铵含氮31.7%,则混入的氮肥可能是 ( )
| A.尿素[CO(NH2)2] | B.硝酸铵 | C.硫酸铵 | D.碳酸铵 |