(8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
.根据要求的化学用语填写
(1)H2O2的电子式为_______________
(2)C2H2的结构式为__________________
(3)常温常压下,1g甲烷完全燃烧生成液态水时放出热量为556kJ,写出甲烷燃烧的热化学方程式__________________________________________________________________
(4)以Fe棒和Cu棒作为两极,氯化铁溶液作为电解质溶液,组成原电池,正极反应式为__________________________________,负极反应式为____________________________
(5)固体离子化合物的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。它的电子式是____________________
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g) 2NH3(g)ΔH <0达到平衡的标志是__________________________(填编号)
2NH3(g)ΔH <0达到平衡的标志是__________________________(填编号)
①反应速率v(N2):v(H2):v(NH3) =" 1" : 3 : 2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)= V(NH3逆)
⑦单位时间内3 mol H—H键断裂的同时2 mol N—H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2)现有八种物质:①干冰;②金刚石;③四氯化碳;④晶体硅;⑤过氧化钠;⑥碳化硅晶体;⑦溴化钠;⑧氖。请用编号填写下列空白:
A.属于原子晶体的是_____________,其中熔点由高到低的顺序为____________
B.属于分子晶体的是_____________________,其中分子构型为正四面体的化合物的电子式为_________________
C.既含有共价键又含有离子键的化合物是_______,其中阳离子个数与阴离子个数之比为_____
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
| 实验要求 |
选项的标号 |
| 除去FeCl3溶液中的FeCl2 |
|
| 从碘水中提取碘单质 |
|
| 提纯混有少混NaCl的KNO3 |
|
| 鉴别NaCl和KCl |
供选择的化学试剂或实验方法如下:
A、加热灼烧,观察
B、在较高温度下溶于水配成浓溶液,再冷却结晶
C、加入四氯化碳萃取
D、加入适量的铁屑
E、通入Cl2气体
某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3。操作讨程如下: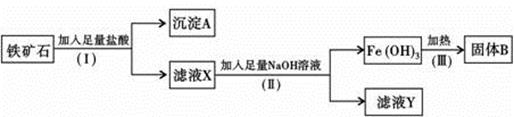
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是;
(2)沉淀A中主要含有,固体B是;
(3)取少量滤液X于试管中滴入几滴KSCN溶液可观察到溶液变成色,滤液Y中的阴离子除OH-、Cl-外,还有;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式
(12分)针对下面10种元素,完成以下各小题。
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
C |
N |
O |
Ne |
||||
| 3 |
Na |
Mg |
Al |
Si |
S |
Cl |
(1)常温下,会在浓硫酸中发生钝化的金属是(填名称)。
(2)化学性质最不活泼的元素是(填元素符号)。
(3)镁的原子结构示意图为。
(4)C与N相比,原子半径较小的是。
(5)最高价氧化物对应的水化物酸性最强的是碱性最强的是(填化学式)。
(6)常用于制半导体材料的元素是。
(7)H2S和HCl相比,热稳定性较强的是。
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式,其中硫元素和氧元素的质量比m(S): m(O)= 。
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式: