下列说法中正确的是(NA表示阿伏加德罗常数) ( )
| A.4℃时,5.4mL水中所含的水分子数是0.3NA |
| B.在常温常压下,11.2L氯气所含的原子数为NA |
| C.标准状况下,22.4L氢气所含的质子数为2 2.4NA |
| D.2L 1mol·L-1K2SO4溶液中离子的总数为3 NA |
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是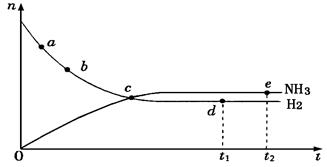
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到平衡 |
| C.点d (t1时刻)和点e (t2时刻)处n (N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |
下列事实,不能用平衡移动原理解释的是
| A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率 |
| B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+ |
| C.选择合适的催化剂可使水在较低温度下分解 |
| D.滴有酚酞的CH3COONa溶液,加热后颜色变深 |
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=1g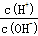 。则下列叙述不正确的是
。则下列叙述不正确的是
| A.中性溶液的AG=0 |
| B.碱性溶液的AG>0 |
| C.AG越大碱性越强,酸性越弱 |
| D.常温下0.1mol·L-1氢氧化钠溶液的AG=-12 |
下列各种溶液中,可能大量共存的离子组是
| A.pH=0的溶液中:Fe2+、NO3-、SO42-、I- |
| B.由水电离出的c(OH-)=1×10-13mol·L-1的溶液中:Na+、[Al(OH)4]-、S2-、CO32- |
| C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3- |
| D.c(H+)=10-14mol·L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
常温下,关于溶液的稀释说法正确的是
| A.将1 L 0.1mol·L-1的Ba(OH)2溶液加水稀释为2L,pH=13 |
| B.pH=3的醋酸溶液加水稀释100倍,pH=5 |
| C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10-6mol·L-1 |
| D.pH=8的NaOH溶液加水稀释100倍,其pH=6 |