室温下,下列各组粒子在指定溶液中一定能大量共存的是
A. pH=0的溶液中: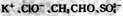 |
B.加入金属镁能产生H:的溶液中: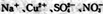 |
C.加人KSCN显血红色的溶液中: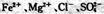 |
D.常温下由水电离出的?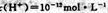 的溶液:: 的溶液::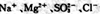 |
在密闭容器中进行反应:A(g)+3B(g) 2C(g),有关下列图像说法的不正确的是
2C(g),有关下列图像说法的不正确的是
| A.依据图a可判断正反应为放热反应 |
| B.在图b中,虚线可表示使用了催化剂 |
| C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
下列实验方案不可行或结论不正确的是
| A.用润湿的pH试纸测定饱和Na2CO3溶液pH |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
| D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH+ 4+OH-  NH3↑+H2O NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO- 4+6H++5H2O2 = 2Mn2++5O2↑+8H2O |
下图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是
| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为0.0100 mol·L-1 |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D.当滴加NaOH溶液10.00 mL时,该混合液的pH= 1+lg3 |
下列说法正确的是
A.右图可表示水分解过程中的能量变化 |
| B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol, |
Ⅱ:
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ