下列各组离子一定能大量共存的是 ( )
| A.在含大量Fe3+的溶液中:NH、Na+、Cl-、SCN- |
| B.在强碱性溶液中:Na+、K+、AlO、CO |
| C.在c(H+)=10-13 mol/L的溶液中:NH、Al3+、SO、NO |
| D.在pH=1的溶液中:K+、Fe2+、Cl-、NO |
下列关于浓硫酸的叙述正确的是
| A.浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B.稀释浓硫酸时,先将浓硫酸加入烧杯中,再加入水并搅拌 |
| C.浓硫酸是一种干燥剂,能够干燥氨气、氧气等气体 |
| D.浓硫酸在常温下能够使铁、铝等金属钝化 |
在下列状态下,能导电的电解质是
| A.氨水 | B.液态氯化氢 | C.二氧化碳气体 | D.熔融氯化钠 |
光纤通讯是光作为信息的载体,让光在光导纤维中传输。制造光导纤维的基本原料是
| A.铜 | B.铁 | C.石英 | D.纯碱 |
氯在自然界以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是
| A.汤姆生 | B.舍勒 | C.阿伏加德罗 | D.戴维 |
(8分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示: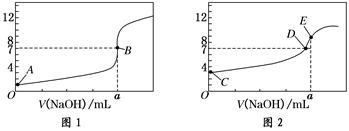
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL;
(3)c(Na+)=c(CH3COO-)的点是________;
(4)E点对应离子浓度由大到小的顺序为________________。