下列实验操作中所用仪器合理的是 ( )
| A.用10 mL 量筒量取5.2 mL 盐酸 | B.用100 mL 量筒量取5.2 mL 盐酸 |
| C.用托盘天平称取25.02 g NaCl | D.用100 mL 容量瓶配制50 mL 0.1 mol/L 的盐酸 |
仪器中①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥滴定管;⑦燃烧匙,常用于物质分离的是()
| A.①③④ | B.①②⑥ | C.①③⑤ | D.③④⑦ |
知X、Y、Z、W四种短周期非稀有气体元素在周期表中的相对位置如图所示,下列说法正确的是( )
| A.Z的原子序数不可能是X的原子序数的2倍 |
| B.Z元素的原子半径可能比Y元素的小 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的最高价氧化物的水化物的酸性一定比W的强 |
列各项中,表达正确的是( )
| A.乙烯的结构简式:C2H4 | B.F原子结构示意图: |
C.NH3的结构式: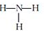 |
D.HCl的电子式: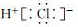 |
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.1 mol Na2O2与SO2完全反应时转移电子数为NA |
| B.18g重水(D2O)所含的电子数为10NA |
| C.0. 5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA |
| D.常温常压下,3gHCHO和CH3COOH的混合物中含有0.4NA个原子 |
将分别通入下列种溶液中,有关说法正确的是()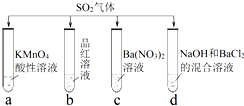
| A.试管a中实验可以证明具有漂白性 |
| B.试管b中溶液褪色,说明具有强氧化性 |
| C.试管c中能产生白色沉淀,说明具有还原性 |
| D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸 |