向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3:1其原因可能是
| A.两溶液的体积相同,酸是多元强酸 |
| B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍 |
| C.两溶液的体积相同,酸是弱酸 |
| D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大 |
已知25℃时BaSO4饱和溶液中存在BaSO4(s) Ba2+(aq)+SO(aq),
Ba2+(aq)+SO(aq),
Ksp=1.1025×10-10,下列有关BaSO4的溶度积和溶解平衡的叙述正确的是( )
| A.25℃时,向c(SO)=1.05×10-5mol/L的BaSO4溶液中,加入BaSO4固体,c(SO)增大 |
| B.向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大 |
| C.向该饱和溶液中加入BaCl2固体,则该溶液中c(SO)减小 |
| D.向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO) |
下列各选项中所述的两个量,前者一定大于后者的是( )
| A.pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| B.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数 |
| C.pH=12的氨水和NaOH溶液的导电能力 |
| D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积 |
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )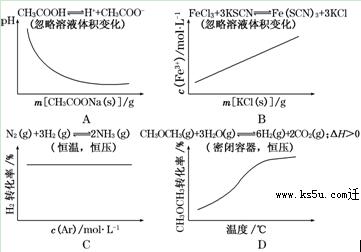
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
①将水加热煮沸
②向水中投入一小块金属钠
③向水中通CO2
④向水中加入明矾晶体
⑤向水中加NaHCO3固体 ⑥向水中加NaHSO4固体
| A.①②④⑤ | B.①④⑤⑥ | C.③④⑤ | D.④ |
关于氯化铁水解的说法错误的是( )
| A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动 |
| B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| D.为抑制Fe3+水解,较好地保存FeCl3溶液,配制时应加少量盐酸 |