把一小块钠投入到硫酸铜溶液中,生成物有
| A.Cu | B.Cu(OH)2 | C.H2 | D.O2 |
在一定条件下,向一体积为2L的恒容密闭容器中充入2mol A,1mol B,发生如下反应: 2A(g)+B 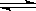 3C(g) △H=-QkJ/mol(Q>0)。经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的
3C(g) △H=-QkJ/mol(Q>0)。经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的
| A.用C的浓度变化表示该反应速率为2.4mol/(L·min) |
| B.若使容器变为1L,则C的物质的量一定增大 |
| C.达到平衡,测得放出热量为x kJ,则x=Q |
| D.若向容器再充入1mol C,重新达平衡,A的体积分数保持不变,则B为气态 |
下列图示与对应叙述相符合的是
A.图I:反应H2+I2 2HI 达平衡后,升高温度时反应速率随时间的变化 2HI 达平衡后,升高温度时反应速率随时间的变化 |
B.图Ⅱ:反应2SO2+O2 2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化 2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
C.图III:反应N2+3H 2 2NH3 在恒温情况下,反应速率与压强的关系 2NH3 在恒温情况下,反应速率与压强的关系 |
D.图IV:反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 |
在密闭容器中进行如下反应:X2(气) + Y2(气)  2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、0.2 mol/L, 在一定的条件下, 当反应达到平衡时,各物质的浓度有可能是
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、0.2 mol/L, 在一定的条件下, 当反应达到平衡时,各物质的浓度有可能是
| A.Y2为0.2 mol/L | B.Y2为0.35 mol/L |
| C.X2为0.2 mol/L | D.Z为 0.4 mol/L |
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是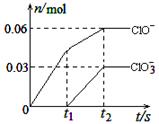
| A.苛性钾溶液中KOH的物质的量是0.09mol |
| B.ClO3-的生成是由于氯气的量的多少引起的 |
| C.在酸性条件下ClO-和ClO3-可生成Cl2 |
| D.反应中转移电子的物质的量是0.21mol |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
溶解度:Na2CO3>NaHCO3 |
向饱和的Na2CO3溶液中通入CO2,析出白色晶体 |
| B |
CaSO3是难溶物 |
向CaCl2溶液中通入SO2产生白色沉淀 |
| C |
NH3能使酚酞溶液变红 |
NH3可用于设计喷泉实验 |
| D |
强酸可与碱及弱酸盐反应 |
用硫酸清洗锅炉中的水垢 |