如下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是
| |
不纯物质 |
除杂试剂 |
分离方法 |
| A |
苯(甲苯) |
KMnO4(酸化),NaOH溶液 |
分液 |
| B |
NH4Cl溶液(FeCl3) |
NaOH溶液 |
过滤 |
| C |
乙酸乙酯(乙酸) |
KOH溶液,水 |
分液 |
| D |
CO2(SO2) |
Na2CO3 |
先气 |
A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期, A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层, 下列叙述正确的是
A.原子序数:A>B>D>C B.金属性B>D,非金属性A>C
C.原子半径:D>B>C>A D.简单离子半径:C>B>D>A
下图是氢氧燃料电池(电解质溶液为H3PO4溶液)构造示意图。关于该电池的说法不正确的是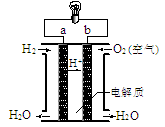
| A.a极是负极 |
| B.电子由a通过灯泡流向b |
| C.正极的电极反应是:O2+2H2O+4e-=4OH- |
| D.氢氧燃料电池是环保电池 |
以下说法正确的是
| A.共价化合物内部可能有极性键和非极性键 |
| B.原子或离子间相互的吸引力叫化学键 |
| C.非金属元素间只能形成共价键 |
| D.金属元素与非金属元素的原子间只形成离子键 |
如果发现了原子序数为116的元素,下列叙述不正确是
①位于第七周期;
②是非金属元素;
③最外电子层含有6个电子;
④没有放射性;
⑤属于氧族元素;
⑥属于卤素。
| A.②④⑥ | B.①③⑥ | C.①③⑤ | D.②③⑤ |
已知短周期元素的离子aA-、bB2-、cC+、dD2+都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径为D>C>A>B | B.原子序数为a>b>c>d |
| C.离子半径为aA->bB2->cC+>dD2+ | D.a+2=c |