下列离子方程式表达正确的是( )
| A.SO2通入溴水中溴水褪色:SO2 + 2H2O + Br2 =2H+ + SO2-4+ 2HBr |
| B.漂白粉溶液在空气中失效:ClO- + CO2 + H2O = HClO + HCO3- |
| C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性: Ba2++ 2OH-+ 2H++ SO2-4= BaSO4↓ + 2H2O |
| D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+ 3H+ = Fe3++ 3H2O |
为减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是
| A.碳水化合物 | B.碳氢化合物 | C.氢气 | D.醇类 |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL2mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为( )





| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH = 4K2CO3+10H2O,有关此电池的推断正确的是()
| A.负极反应为14H2O+7O2+28e- = 28OH- |
| B.放电一段时间后,负极周围的pH升高 |
| C.放电过程中KOH的物质的量浓度不变 |
| D.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol |
T ℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是()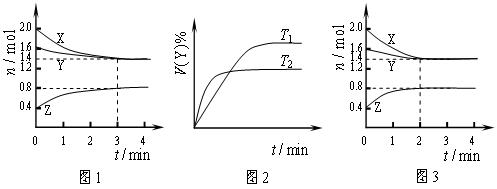
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.保持其他条件不变,升高温度,平衡逆向移动 |
| C.反应进行的前3min内,用X表示的反应速率 v(X)=0.1mol•L-1•min-1 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
“魔棒”常被用于晚会现场气氛的渲染。其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为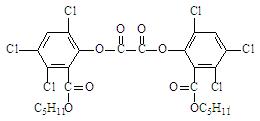
下列有关说法不正确的是()
| A.草酸二酯属于芳香族化合物 | B.草酸二酯的分子式为C26H24O8Cl6 |
| C.草酸二酯难溶于水 | D.1mol草酸二酯最多可与4molNaOH反应 |