低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
 H<0
H<0
在恒容的密闭容器中,下列有关说法正确的是
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| K2 |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格判断以下说法中不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为 H2SO4 =2H+ +SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
在密闭容器中进行下列反应:M(g)+N(g) 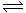 R(g)+2L,此反应符合下面图像,下列叙述正确的是
R(g)+2L,此反应符合下面图像,下列叙述正确的是 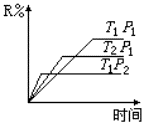
| A.正反应吸热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应放热,L是气体 |
| D.正反应放热,L是固体或液体 |
一定温度下,将1 mol A和1 mol B气体充入2L恒容密闭容器中,发生如下反应: A(g)+B(g) x C(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C 的浓度随时间变化如图所示。下列说法正确是
x C(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C 的浓度随时间变化如图所示。下列说法正确是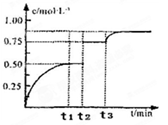
| A.反应方程式中的x=1 |
| B.t1~t3间该反应的平衡常数均为4 |
| C.t3时刻改变的条件是移去少量物质D |
| D.t3时刻改变的条件是使用催化剂 |
在密闭容器中充入一定量NO2,发生反应2NO2(g)  N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是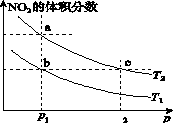
| A.a、c两点的反应速率:a>c |
| B.a、b两点NO2的转化率:a<b |
| C.a、c两点气体的颜色:a深,c浅 |
| D.由a点到b点,可以用加热的方法 |
在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下反应,达到平衡时,H2的转化率为25%,则平衡时氨气的体积分数接近于
| A.5% | B.10% | C.15% | D.20% |