1,2 - 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃ ,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2
,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2 - 二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
- 二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式。
____________________________________________________________
____________________________________________________________
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管 d是否发生堵塞.请写出发生堵塞时瓶b中的现象。
d是否发生堵塞.请写出发生堵塞时瓶b中的现象。
_________________________________。
(3)容器c中NaOH溶液的作用是:__________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性 没有问题,试分析其可能的原因是:
没有问题,试分析其可能的原因是:
____________________________________________________________
利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
(1)检验FeSO4是否已有部分氧化的方法是。
(2)已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。请补充化学方程式:
TiOSO4 +=H2SO4 + H2TiO3↓;铁粉的作用有:①除去溶液中的Fe3+,②。
(3)沉淀反应的离子方程式是。
(4)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有。FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致FeC2O4的产率______(填“偏高”、“偏低”或“无影响”)。
(5)过滤2得到的滤液经蒸发浓缩、、洗涤可得到副产品,该物质可用作(写出一种用途)。
(16分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。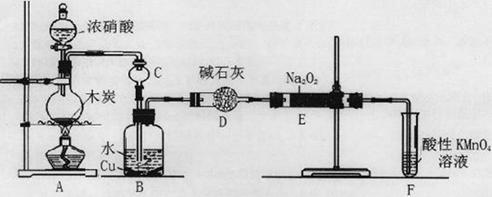
已知:室温下,① 2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O。
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
| A.自来水 | B.碘化钾淀粉试液 | C.淀粉 | D.白糖 E.食醋 F.白酒 |
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 ml,取出25 ml溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20ml,求样品中亚硝酸钠的质量分数(保留小数点后1位)(已知:NaNO2摩尔质量69g/mol)
实验室模拟合成氨和氨催化氧化的流程如下: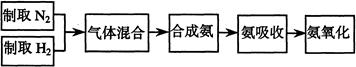
(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式。从下图中选择制取氮气的合适装置。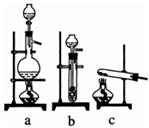
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有。
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:,锥形瓶中还可观察到的现象是:。
(4)反应结束后锥形瓶内的溶液中含有H+、OH-、离子。
氮化铝(AlN)是一种新型无机材料。某氮化铝(AlN)仅含有Al2O3杂质,某学习小组为测定该氮化铝样品中AlN的纯度,查阅资料得知:AlN + NaOH + 3H2O = Na[Al(OH)4] + NH3↑。设计如下2种方案。
方案一:量气法——如图所示。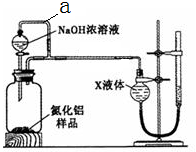
(1)按图连接好装置,检查装置气密性的方法是。
(2) 导管a的主要作用是。
(3)为测定生成气体的体积,量气装置中的X液体可以是:。(填标号)
| A.CCl4 | B.H2O | C.NH4Cl溶液 | D.植物油 |
(4)若取m g样品与NaOH浓溶液完全反应后,测得生成气体的体积为V mL(标准状况)。则样品中AlN的纯度为___________。
方案二:重量法——如下图所示。
(5)步骤①中,氧化铝与氢氧化钠溶液反应的离子方程式为_______________。
(6)样品中AlN的纯度为___________。
(7)若测得样品中AlN的纯度偏高,可能的原因是___________。(写1点)
利用某含铬废液[含较低浓度的Na2Cr2O7、Fe2(SO4)3]制备K2Cr2O7。
流程如下:
Ⅰ.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤;
Ⅱ.向滤液中加入Na2SO3,一定操作后分离出Na2SO4;
Ⅲ.将分离出Na2SO4后的溶液调pH约为5,得到Cr(OH)3沉淀;
Ⅳ.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液;
Ⅴ.向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体;
Ⅵ.测定K2Cr2O7固体的纯度。
已知:Cr2O72-(橙红色)+H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
(1)步骤Ⅰ中红褐色沉淀的化学式是。
(2)步骤Ⅱ中加入Na2SO3的目的是。
(3)步骤Ⅳ中反应的离子方程式是。
(4)步骤Ⅴ中加入的物质A可以是。(填序号)
a.KOH b.K2CO3 c.H2SO4 d.SO2
(5)步骤Ⅵ的操作是:取0.45 g K2Cr2O7产品配成溶液,酸化后滴入18.00 mL
0.50 mol/L的FeSO4溶液,恰好使Cr2O72-完全转化为Cr3+。产品中K2Cr2O7的纯度是。(注:K2Cr2O7的摩尔质量为294 g/mol)
(6)向橙红色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是,溶液pH变小的原因是。