高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程式为: 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
干法制备的主要反应方程式为: 2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
| A.高铁酸钾中铁显+6价 |
| B.湿法中每生成1 mol Na2FeO4转移3 mol电子 |
| C.干法中每生成1 mol Na2FeO4转移4 mol电子 |
| D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是()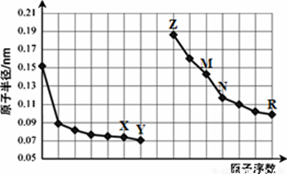
| A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B.简单离子的半径:X>Z>M |
| C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z单质能从M与R元素构成的盐溶液中置换出单质M |
有机物X、Y、M(已知M为乙酸)的转化关系为:淀粉→X→Y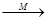 乙酸乙酯,下列说法错误的是
乙酸乙酯,下列说法错误的是
| A.X可用新制的氢氧化铜悬浊液检验 |
| B.实验室由Y和M制取乙酸乙酯时可用饱和NaOH溶液来提纯 |
| C.由Y生成乙酸乙酯的反应属于取代反应 |
| D.可用碘水检验淀粉是否水解完全 |
下列对于与生产、生活有关的化学问题的分析正确的是()
| A.对“地沟油”进行分馏可得到汽油 |
| B.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
| C.误食可溶性重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶 |
| D.PM 2.5、二氧化碳都属于空气质量日报的内容 |
【化学—物质结构与性质】
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中。
(1)N原子价电子轨道表示式;
(2)PCl5晶体中只有PCl4+和PCl6-微粒,其晶体结构与氯化铯相同。PCl5晶体类型是;PCl4+的空间构型是;
(3)PCl6-呈正八面体的结构(如图),该离子中(填“是”或“否”)存在配位键,原因是;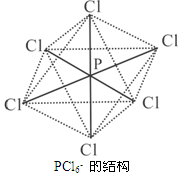
(4)NCl3分子中,N原子杂化方式是;NCl3不稳定,易发生分解:2NCl3(l)=N2(g)+3Cl2(g),分解过程中形成σ键和π键数目之比为;
(5)C、N、O三种元素的第五电离能(I5)由大到小顺序是。
对于反应aA+bB=dD+eE,该化学反应速率定义为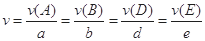 。式中
。式中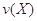 指物质
指物质 的反应速率,
的反应速率, 、
、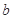 、
、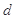 、
、 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
| 实验编号 |
1 |
2 |
3 |
4 |
| c(HI)/ mol·L-1 |
0.100 |
0.200 |
0.300 |
0.100 |
| c(H2O2)/ mol·L-1 |
0.100 |
0.100 |
0.100 |
0.200 |
| v/ mol·L-1·s-1 |
0.00760 |
0.0153 |
0.0227 |
0.0151 |
以下说法正确的是
A.实验1、2中,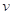 (H2O2)相等
(H2O2)相等
B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时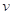 ="0.0304" mol·L-1·s-1
="0.0304" mol·L-1·s-1
C.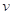 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数
D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1