某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子。若向其中加入Na2O2粉末,充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
| A.NO3- | B.CO32-、NO3- | C.SO32-、NO3- | D.CO32-、NO3-、Na+ |
有关常温下pH均为3的醋酸和硫酸的说法正确的是 ( )
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
25℃时,水的电离达到平衡:H2O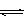 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
下列化学反应的离子方程式正确的是
| A.往碳酸钡中滴加稀盐酸:CO32-+2H+=CO2↑+H2O |
| B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C.往氨水中滴加氯化铝:Al3++4OH-=[Al(OH)4]- |
| D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
若NA表示阿伏加德罗常数,下列说法正确的是()
| A.含有NA个氖原子的氖气在标准状况下的体积约为11.2L |
| B.2.3gNa被O2完全氧化时,失去电子数为0.1NA。 |
| C.2Llmol·L-1的盐酸中所含氯化氢分子数约为2NA |
| D.标准状况下,5.6LCCl4含有的分子数为0.25NA |
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是 ( )Ⅰ
| A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠 |
| B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液 |
| C.最后变成碳酸钠粉末 |
| D.该过程的所有化学反应均为氧化还原反应 |