(12分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法 如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是
;
(2)K2MnO4制备KMnO4的离子方程式是 ;
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是 ;
(5)上述制得的KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。
为了检验淀粉水解的产物,某学生设计了如下实验方案:
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________________ 。
(2)试剂2为___________ ,其作用是_________________________;
发生反应的离子方程式为:_________________________________。
(3)反应①的化学方程式为_____________________________________。
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_____________________________。
苯是最重要的基本有机化工原料之一,现利用苯,同时使用其他部分试剂,可实现如下转化: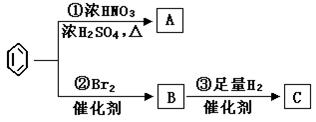
请回答下列问题:
(1)C的结构简式为__________________________ ;
(2)写出下列反应的化学方程式:
反应①:__________________________________;
反应②:__________________________________ ;
(3)上述反应①~③中,属于加成反应的是_________(填序号)。
新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,为检验其成分,某研究性学习小组做了如下实验,请根据所做实验,按要求填空。
(1)取少量新制氯水于试管中,加入碳酸钙粉末,发现有气泡产生,则说明起作用
的成分是HCl,HCl表现出性。
(2)取少量新制氯水于试管中,加入AgNO3溶液,发现有白色沉淀产生,则起作用的是。
(3)取少量新制氯水于试管中,加入一块红纸,发现很快褪色,则起作用的是。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有性。
(8分)为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求填写下列空格:
(1)如图1所示,试管中装乙醇产生的气体为;
(2)如图2所示,把加热的铜丝插入到装有乙醇的试管中,闻到有刺激性气味,该反应中产生的有机物为;
(3)用食醋浸泡有水垢(主要成分CaCO3)的水壶,可以清除水垢,说明醋酸的酸性碳酸的酸性。(填“强于”或“弱于”)
(4)按如图3所示装置,甲试管中装有乙酸、乙醇、浓硫酸,则在装有饱和碳酸钠溶液的乙试管上方可闻到有特殊香味的物质,该物质为。
现有常见金属A、B,它们之间存在如下的转化关系(图中有些反应的产物和反应的条件没有全部标出),其中G、H为白色沉淀。请回答下列问题: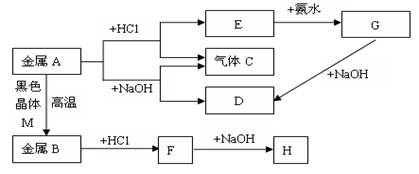
(1)写出金属A和物质D的名称或化学式:、。
(2)写出E转化为G的离子方程式;
(3)写出H放在空气中的现象:。