下列说法正确的是 ( )
| A.10电子的离子对H2O的电离平衡均能产生影响 |
B. 与 与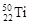 两种核素均是周期表第四周期主族元素 两种核素均是周期表第四周期主族元素 |
| C.IA族元素的原子半径比ⅦA族元素的原子半径大 |
| D.原子序数相差8的两种短周期元素,其周期序数相差1 |
应用纳米新材料能给人民币进行杀菌、消毒。我国纳米专家王雪平发明的“WXP复合纳米材料”的主要化学成份是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用。有鉴于此,35位人大代表联名提交了一份议案,要求加快将此新技术应用到人民币制造中去。若戊二醛是直链的,请你根据所学的知识推断沸点不同的氨基二氯代戊二醛的同分异构体可能有
| A.5种 | B.6 种 | C.8种 | D.10种 |
下列电离方程式中,错误的是
A.H2CO3 H++HCO3- ; HCO3- H++HCO3- ; HCO3- H++CO32- H++CO32- |
| B.H2SO4 ="=" 2H++SO42- |
| C.NaHS ="=" Na++H++S2- |
D.CH3COOH  H++ CH3COO― H++ CH3COO― |
下列各选项中所述的两个量,前者一定大于后者的是
| A.室温下,1L0.3mol·L-1CH3COOH溶液和3L0.1 mol·L-1CH3COOH溶液中的H+数 |
| B.纯水在25℃和80℃时的pH |
| C.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
| D.相同条件下,H2分别与Cl2、F2反应的反应速率 |
TiO2在光照射下可使水分解:2H2O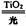 2H2↑+O2↑,该过程类似植物的光合作用。右图是光照射下TiO2分解水的装置示意图。下列叙述正确的是
2H2↑+O2↑,该过程类似植物的光合作用。右图是光照射下TiO2分解水的装置示意图。下列叙述正确的是
| A.该装置可以将电能转化为化学能 |
| B.铂电极上发生的反应为:2H++2e-=H2↑ |
| C.该装置工作时,电流由TiO2电极经R流向铂电极 |
| D.该装置工作时,TiO2电极附近溶液的pH变大 |
近年来科学家利用合成的方法制备了多种具有特殊结构的有机物,例如具有下列立体结构的环状化合物(其中碳、氢原子均已略去):
有人认为上述有机物中,①立方烷,棱晶烷、金刚烷可以看作是烷烃的同系物;②盆烯是单烯烃;③棱晶烷、盆烯是苯的同分异构体;④金刚烷是癸炔的同分异构体以上叙述正确的是
| A.③ | B.①和③ | C.②和④ | D.除①外都正确 |