一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol·L—1KOH溶液,下列说法不正确的是 ( )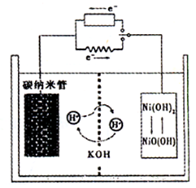
| A.储存H2的碳纳米管放电时为负极,充电时为阴极 |
| B.放电时负极附近pH减小 |
| C.放电时电池正极的电极反应为 NiO(OH)+H2O+e—===Ni(OH) 2+OH— |
| D.放电时,电池反应为2H2+O2===2H2O |
下列离子组能大量共存的是
| A.使甲基橙呈红色的溶液中K+ 、Na+、NO3-、S2O32- |
| B.NH4+、Fe3+、CO32-、CH3COO- |
| C.使酚酞变红色的溶液中: Na+、 Cl-、K+、AlO2- |
| D.无色透明溶液中:SO32-、Cl-、K+、Cr2O72- |
用水稀释0.1molL –1的醋酸溶液,其中随水的增加而增大的有
①H+的物质的量,②C(H+),③C(OH-),④C(H+)/C(CH3COOH),⑤C(CH3COOH)/ C(CH3COO—)
| A.①③④ | B.①③⑤ | C.②④ | D.③④ |
pH相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌全部溶解且放出气体一样多,则下列说法正确的是
| A.反应开始时的速率:甲=乙 |
| B.反应所需时间:甲<乙 |
| C.反应开始时,酸的物质的量浓度:甲=乙 |
| D.反应结束时,溶液pH:甲<乙 |
恒温恒容条件下,进行以下反应:H2(g)+ Br2(g) 2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
| A.达平衡时HBr物质的量一定仍为a mol |
| B.两平衡压强比为3:(x+y+z) |
| C.达平衡时HBr的物质的量为(x+y+z)a/3 |
| D.x、y、z应满足的关系是 4x+z= 2y |
在一定温度下,反应AB(g)  1/2 A2(g)+1/2 B2(g)的平衡常数为0.1。若将1.0 mol的AB(g)通入体积为1.0 L的密闭容器中,在该温度时AB(g)的最大分解率接近于
1/2 A2(g)+1/2 B2(g)的平衡常数为0.1。若将1.0 mol的AB(g)通入体积为1.0 L的密闭容器中,在该温度时AB(g)的最大分解率接近于
| A.5% | B.17% | C.25% | D.33% |