某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L 的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( ) 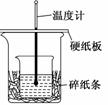
| A.如图条件下实验过程中没有热量损失 |
| B.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求反应热相等 |
| C.图中实验装置缺少环形玻璃搅拌棒 |
| D.烧杯间填满碎纸条的作用是固定小烧杯 |
向甲、乙两个容积均为1L的恒容容器中分别充入2molA、2molB和1molA、1molB。相同条件下发生如下反应:A(g)+B(g)  xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法错误的是()
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法错误的是()
A.x可能等于2也可能等于3
B.若向平衡后的乙容器充入C,则再次达到平衡时A的体积分数减小
C.若升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同
D.若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol/L<c(A)<0.5mol/L
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应:X(g)+Y(g)  2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是()
2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是()
| 0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
| X |
1 |
0.80 |
0.66 |
0.58 |
0.52 |
0.50 |
0.50 |
| Y |
2 |
1.80 |
1.66 |
… |
… |
… |
… |
A.前5min用Z表示的平均反应速率为0.2mol/(L·min)
B.该反应的正反应是放热反应,且T1>T
C.在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的体积分数不变
D.若温度为T1时,以同样的起始量反应,达到平衡时X的转化率为66.7%
己知lg2="0.3" ,lg5 =" 0.7" ,某温度(t℃)时,测得0.0lmol/L的NaOH溶液的pH="11" 。在此温度下,将60mLpH=1的H2SO4溶液与40mL0.1mol/L的Ba(OH)2溶液混合(忽略溶液混合体积的变化),所得溶液的pH为()
| A.12.3 | B.11.7 | C.11.3 | D.12.7 |
已知: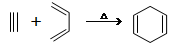 ,如果要合成
,如果要合成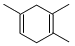 所用的原始原料可以是()
所用的原始原料可以是()
①2-甲基-l,3-丁二烯和2-丁炔②1, 3-戊二烯和2-丁炔
③2, 3-二甲基-1, 3-戊二烯和乙炔④2, 3-二甲基-l, 3-丁二烯和丙炔
| A.②③ | B.①④ | C.②④ | D.只有① |
烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH CHR2,被氧化为
CHR2,被氧化为 被氧化为
被氧化为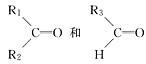 ,由此推断分子式为C4H8的烯烃在该条件下的氧化产物有(不考虑顺反异构)()
,由此推断分子式为C4H8的烯烃在该条件下的氧化产物有(不考虑顺反异构)()
| A.2种 | B.3种 | C.4种 | D.6种 |