在一密闭容器中有如下反应:L(s)+aG(g) bR(g) 温度和压强对该反应的影响如右图所示,
bR(g) 温度和压强对该反应的影响如右图所示,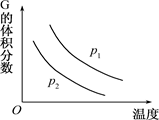
其中压强p1<p2,由此可判断
| A.正反应为放热反应 |
| B.化学方程式中的计量数a>b |
| C.G的转化率随温度升高而减小 |
| D.增大压强,容器内气体质量不变 |
以下实验装置一般不用于分离物质的是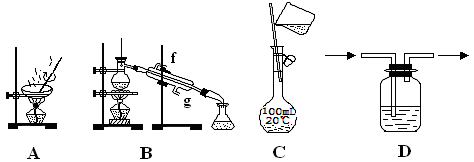
某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是:
| A.Ba(NO3)2、K2CO3、AgNO3、HNO3 | B.K2CO3、Ba(NO3)2、AgNO3、HNO3 |
| C.Ba(NO3)2、K2CO3、HNO3、AgNO3 | D.AgNO3、Ba(NO3)2、K2CO3、HNO3 |
下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶的液体时,取下瓶塞倒立放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热。
| A.①④⑦⑩ | B.①④⑤⑦⑩ | C.①④⑤⑦⑧⑩ | D.④⑤⑦⑧⑩ |
在蒸馏实验中,下列叙述不正确的是
| A.在蒸馏烧瓶中盛约1/3体积的自来水,并放入几粒沸石 |
| B.将温度计水银球插入自来水中 |
| C.冷水从冷凝管下口入,上口出 |
| D.收集蒸馏水时,应弃去开始馏出的部分 |
某实验小组只领取下列仪器和用品:铁架台、铁夹、铁圈、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。不能进行的实验操作是
| A.蒸馏 | B.萃取 | C.过滤 | D.蒸发 |