将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol·L-1的HC1溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HC1溶液体积为V2L.将溶液蒸干充分灼烧得到固体W2g.下列关系式中错误的是 ( )
| A.24n(A1)+35.5n(Na)=W2—W1 | B.n(Na)+3n(A1)=aV2 |
| C.n(Na)+3n(A1)=V1/11.2 | D.aV2=V1/22.4 |
下列实验现象的描述错误的是
| A.氢气在氯气中燃烧产生苍白色火焰 |
| B.红热的铁丝在氯气中燃烧,火星四射,生成黑色固体颗粒 |
| C.红热的铜丝在氯气中燃烧,产生棕黄色烟 |
| D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
用下面的方案进行某些离子的检验,其中方案设计最可行的是
A.检验试液中的SO42-:试液 无沉淀 无沉淀 白色沉淀 白色沉淀 |
B.检验试液中的Fe2+:试液 无明显现象 无明显现象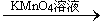 红色溶液 红色溶液 |
C.检验试液中的 :试液 :试液  棕黄色溶液 棕黄色溶液  蓝色溶液 蓝色溶液 |
D.检验试液中的CO32-:试液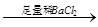 白色沉淀 白色沉淀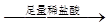 沉淀溶解 沉淀溶解 |
下列离子方程式书写正确的是
| A.AlCl3溶液中加入过量Na2O反应:3Na2O+3H2O+2Al3+=2Al(OH)3↓+6Na+ |
| B.澄清石灰水中通入过量HCl:OH-+H+=+H2O |
| C.过氧化钠与冷水反应:2O22-+2H2O=4OH-+O2↑ |
| D.H2SO4与Ba(OH)2混合:SO42-+Ba2++H++OH-=BaSO4↓+H2O |
下列推断正确的是
| A.SiO2是酸性氧化物,不能与任何酸反应 |
| B.Na2CO3、NaHCO3都是盐,都能与CaCl2溶液反应 |
| C.CO、NO都是大气污染气体,在空气中都能稳定存在 |
| D.将SO2通入Ba(ClO)2的溶液中,生成BaSO4沉淀 |
下列选项中所涉及的两个量一定相等的是
| A.11.2 L N2与14 g CO气体所含有的原子数 |
| B.电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| C.6.2 g Na2O和7.8 g Na2O2中所含的离子数 |
| D.18 g重水(D2O)与17 g NH4+所含有的电子数 |