下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A.2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
| B.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 |
| C.任何条件下,16gCH4与18 g H2O所含有电子数均为10NA |
| D.22.4 L的CO气体与1 mol N2所含的电子数相等 |
有关AgCl沉淀的溶解平衡的说法中,不正确的是( )
| A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl沉淀的溶解度增大 |
| D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低 |
蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式 是爱迪生蓄电池分别在充电和放电时发生的反应:Fe+NiO2
是爱迪生蓄电池分别在充电和放电时发生的反应:Fe+NiO2 +2 H2O
+2 H2O Fe(OH)2+Ni(OH)2 下列有关对爱迪生蓄电池的推断错误的是
Fe(OH)2+Ni(OH)2 下列有关对爱迪生蓄电池的推断错误的是
| A.放电时,Fe是负极,NiO2是正极 |
| B.充电时,阴极上的电极反应式为Fe(OH)2+2e-====Fe+2OH- |
| C.放电时电解质溶液中的阴离子是向正极方向移动 |
| D.蓄电池的电极必须浸入碱性电解质溶液中 |
有关下图装置中的叙述正确的是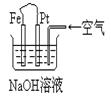
| A.这是电解NaOH溶液的装置 |
| B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2 沉淀的颜色 |
| C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH- |
D.Fe为阳极,其电极反应 为:Fe-2e-+2OH-=2Fe(OH)2 为:Fe-2e-+2OH-=2Fe(OH)2 |
某同学按图所示的装置进行电解实验。下列说法正确的是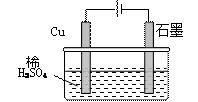
| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为:Cu+2H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解一定时间后,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
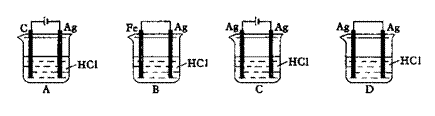
某同学为了使反应2HCl+2A g
g2AgCl+H2↑能进行,设计了如下图示的 四
四 个实验,你认为可行的方案是
个实验,你认为可行的方案是