下列能达到实验目的的是 ( )
)
| A.用NaOH溶液除去CO2中混有的HCl气体 |
| B.用分液漏斗分离四氯化碳和水的混合物; |
| C.加入盐酸以除去硫酸钠中的少许碳酸钠杂质 |
| D.配制一定浓度的氯化钾溶液1000mL,准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量不变的是
| A.硝酸 | B.无水乙醇 | C.石灰水 | D.盐酸 |
能一次区分CH3CH2OH、CH3COOH、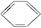 和CCl4四种物质的试剂是
和CCl4四种物质的试剂是
| A.H2O | B.NaOH溶液 | C.盐酸 | D.石蕊试液 |
下列说法正确的是
| A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 |
| B.分子组成符合CnH2n+2的烃一定是烷烃 |
| C.正戊烷分子中所有原子均在一条直线上 |
| D.碳氢原子个数比为1:3的烃有2种 |
交警对驾驶员是否饮酒进行检测的原理是橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是①乙醇沸点低 ②乙醇密度比水小 ③乙醇具有还原性 ④乙醇是烃的含氧衍物⑤乙醇可与羧酸在浓硫酸的作用下发生取代反应
| A.②⑤ | B.②③ | C.①③ | D.①④ |
Cu粉放入稀H2SO4中,无现象,当再加入一种盐后,Cu粉逐渐溶解,此盐是
| A.NaCl | B.CuSO4 | C.KNO3 | D.Na3PO4 |