在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
| A.a>b | B.平衡向正反应方向移动了 |
| C.A的转化率减小了 | D.B的质量分数减小了 |
NaOH、Na2CO3、NaCl、Na2SO4可按不同标准分类,下列分类标准不正确的是
| A.钠的化合物 | B.电解质 | C.可溶于水 | D.钠盐 |
在晨雾散去之后,常会有晶莹的露珠挂在蜘蛛丝上。受这一现象启发,我国利用尼龙纤维等材料制造出了类似的“吸水蜘蛛丝”。该材料有望将来用于从空气中获取水分。下列说法不正确的是
| A.蜘蛛丝属于天然纤维素 |
| B.该材料可能含有许多亲水基团,如羟基 |
| C.该材料不属于天然纤维素 |
| D.蜘蛛丝属于天然蛋白质,其水解产物为α-氨基酸 |
下列说法正确的是
| A.使紫色石蕊试液变红的溶液中:Fe2+、Cu2+、Cl-、NO3-能够大量共存 |
| B.加入铝粉放出H2的溶液中:Na+、Mg2+、HCO3-、SO42-不能大量共存 |
| C.常温下,醋酸钠与醋酸的混合液PH=7:则c(Na+)= c(CH3COO-) |
| D.0.1mol/L NaHCO3溶液中:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3) |
图中a、b、c、d、e、f表示元素周期表中部分短周期元素,下列叙述正确的是
| A.a、b、c的简单离子中,的离子半径最大 |
| B.c、d、f最高价氧化物对应的水化物两两之间均可发生反应 |
| C.e的氢化物比f的氢化物的稳定性高 |
| D.a、e可形成一种新型无机非金属材料——高温结构陶瓷 |
下列实验不能达到预期目的的是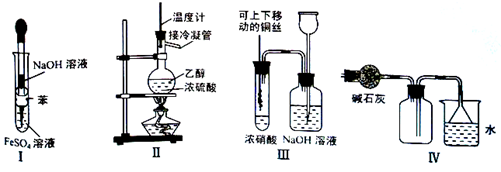
| A.利用Ⅰ制取Fe(OH)2 |
| B.利用Ⅱ装置制取C2H4 |
| C.利用Ⅲ装置进行铜与浓硝酸反应的实验 |
| D.利用Ⅳ装置收集NH3 |