在浓盐酸中H3AsO3与SnCl2反应的离子方程式为: 3SnCl2+12Cl-+2H3AsO3+6H+===2As+3SnCl+6M,关于该反应的说法中正确的组合是:
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol ④M为OH- ⑤SnCl是氧化产物
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.①③ |
下列说法正确的是
| A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 |
| B.配制FeSO4溶液时,将FeSO4固体溶于浓盐酸中,然后稀释至所需浓度 |
| C.用加热的方法可以除去KCl溶液中的Fe3+ |
| D.洗涤油污常用热的碳酸钠溶液 |
无色透明溶液中能大量共存的离子组是
| A.Na+、Al3+、HCO3-、NO3- | B.AlO2-、Cl-、Mg2+、K+ |
| C.NH4+、Na+、CH3COO-、NO3- | D.Na+、NO3-、ClO-、I- |
一定温度下,水存在H2O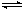 H++OH-ΔH>0的平衡,下列叙述一定正确的是
H++OH-ΔH>0的平衡,下列叙述一定正确的是
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变 |
室温下,下列溶液中粒子浓度关系正确的是
| A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D.CH3COONa溶液:c(Na+)>c(CH3COO-) |
某温度下,某反应达平衡时平衡常数K=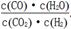 。恒容时,温度升高,H2的浓度减小。下列说法正确的是
。恒容时,温度升高,H2的浓度减小。下列说法正确的是
| A.恒温恒容下,增大压强,H2的浓度一定减小 |
| B.该反应的焓变为正值 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO+H2O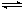 CO2+H2 CO2+H2 |