维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如右图。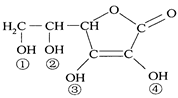
下列有关说法中正确的是
A.维生素C的分子式为C6H10O6
B.维生素C由于含有酯基而难溶于水
C.维生素C由于含有C=O键而能发生银镜反应
D.维生素C的酸性可能是③、④两个羟基引起的
下列方程式书写正确的是
| A.NaHCO3的电离方程式:NaHCO3===Na++H++CO32- |
| B.往AlCl3溶液中滴加NaHCO3溶液 Al 3+ + 3HCO3—=Al(OH)3↓+ 3CO2↑ |
| C.往AgI悬浊液中滴加Na2S饱和溶液:2Ag++S2—===Ag2S↓ |
D.HS—水解的离子方程式:HS—+H2O H3O++ S2- H3O++ S2- |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含 盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是
盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl | B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 | D.AgCl是还原产物 |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g) 2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37. 5%,Y的转化率为25%,下列有关叙述正确的是
2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37. 5%,Y的转化率为25%,下列有关叙述正确的是
| A.若X的反应速率为0.2 mol·L-1·s-1,则Z的反应速率为0.3 mol·L-1·s-1 |
| B.若向容器中充入氦气,压强增大,Y的转化率提高 |
| C.升高温度,正反应速率减小,平衡向逆反应方向移动 |
| D.开始充入容器中的X、Y物质的量之比为2∶1 |
已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2mol SO2、1mol O2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是
| A.向乙容器中充入一定量的氦气 | B.向乙容器中充入一定量的SO3气体 |
| C.升高乙容器的温度 | D.增大甲容器的压强 |