在新制的氯水中存在下列平衡:Cl2+H2O?H++Cl-+HClO,若向氯水中加入少量Na2CO3粉末,溶液中发生的变化是( )
| A.pH增大,HClO浓度减小 | B.pH减小,HClO浓度增大 |
| C.pH增大,HClO浓度增大 | D.pH减小,HClO浓度减小 |
下列说法正确的是:
| A.SiH4比CH4稳定 | B.Na和Cs属于ⅠA族元素,Cs失电子能力比Na的强 |
| C.O2―半径比F―的小 | D.P和As属于ⅤA族元素,H3PO4酸性比H3AsO4的弱 |
简单原子的原子结构可用下图的表示方法来形象表示,其中 表示质子或电子,
表示质子或电子, 表示中子。则下列有关①②③的叙述中正确的是:
表示中子。则下列有关①②③的叙述中正确的是:
| A.①、②、③互为同位素 | B.①、②、③互为同素异形体 |
| C.①、②、③是三种化学性质不同的粒子 | D.①、②、③具有相同的质量数 |
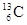 -NMR(核磁共振)可用于含碳化合物的结构分析,
-NMR(核磁共振)可用于含碳化合物的结构分析,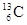 表示的含义是:
表示的含义是:
| A.核内有6个质子,核外有13个电子 |
| B.表示碳元素的一种单质 |
| C.质量数是13,原子序数是6,核内有7个质子 |
| D.质量数是13,原子序数是6,核内有7个中子 |
下列有关材料的说法不正确的是:
| A.航天飞机使用的隔热陶瓷瓦为复合材料 |
| B.复合材料由基体和增强体组成 |
| C.复合材料既保持原有材料的特点,又有优于原材料的特性 |
| D.纯金属的性能一般优于合金 |
A、B、C、D、E分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知(1)A、C均能与稀H2SO4反应放出气体;(2)B与D的硝酸盐反应,置换出单质D;(3)C与强碱反应放出气体; (4)C、E在冷浓硫酸中发生钝化反应,由此可以推断A、B、C、D、E依次为:
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe