下列离子方程式中,正确的是
| A.向Mg(HCO3)2溶液中加入过量的NaOH溶液 Mg2++2HCO  +2OH— +2OH— |
| B.溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2=2Fe3++2Cl- |
C.少量的CO2通入稀的碳酸钠溶液中:CO2+CO32-+H2O |
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO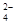 反应完全 反应完全 |
2Ba2++4OH—+Al3++2SO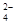
2BaSO4↓+AlO +2H2O
+2H2O
室温下,下列各组离子在指定溶液中可以大量共存的是
| A.pH = 12的溶液:Ca2+、NH4+、Br-、HSO3- |
| B.无色溶液:K+、Al3+、HCO3-、Cl- |
| C.通入H2S无沉淀的溶液:Fe2+、Na+、I-、SO42- |
| D.c(H+) = 1×10-2mol/L的溶液:Fe2+、Br-、ClO-、Cl- |
用下列装置进行相应实验,能达到实验目的的是
| A.图1为牺牲阳极的阴极保护法,可以防止铁棒被腐蚀 |
| B.图2所示装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯 |
| C.图3所示装置可以用来制备氢氧化亚铁 |
| D.图4所示装置可以用来测定中和热 |
(原创)下列各组物质与其用途的关系正确的是
| A.碘化钾——食盐中的加碘物质 | B.二氧化硅——太阳能电池 |
| C.福尔马林——食品保鲜剂 | D.水玻璃——耐火材料 |
一定温度下,向2.0 L恒容密闭容器中充入1.0 mol A,经一段时间后反应A(g) B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(B)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
A.前50 s内B的平均反应速率v(B)=0.0032 mol·L-1·s-1
B.相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大
C.相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆)
D.若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol·L-1,则反应的ΔH<0
25 ℃时某些弱酸的电离平衡常数如下表所示:
| CH3COOH |
HClO |
H2CO3 |
| K(CH3COOH) =1.8×10-5 |
K(HClO) =3.0×10-8 |
K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.图像中a、c两点所处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—