在BaCl2溶液中通入SO2气体,溶液仍澄清;若将BaCl2溶液分盛到两支试管中,其中一支加入硝酸,另一支加入烧碱溶液,然后再通入SO2气体,结果两支试管都有白色沉淀生成。由此得出下列结论合理的是:①氯化钡有两性 ②两支试管中生成的白色沉淀均是亚硫酸钡 ③SO2有还原性和溶于水显酸性 ④升高pH使SO2水溶液中SO2-3的浓度增大
| A.①② | B.②③ | C.③④ | D.①④ |
已知0.1 mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是
| A.加入少量NaOH固体,钠离子和碳酸根离子浓度均增大 |
B.将该溶液加水稀释,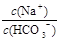 的比值保持不变 的比值保持不变 |
| C.c(Na+)+c(H+)=c(HCO3- )+c(CO32-)+c(OH-) |
| D.c(Na+)=c(HCO3- )+2c(CO32-)+c(H2CO3) |
下列说法正确的是
| A.HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性 |
| B.煤的干馏是物理变化,煤的气化和液化是化学变化 |
| C.纤维素、蛋白质、油脂在一定条件下都能发生水解反应 |
| D.分子式为CH4O和C2H6O的物质一定互为同系物 |
2011年是国际化学年,中国的宣传口号是“化学——我们的生活,我们的未来”。下列有关叙述错误的是
| A.在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 |
| B.大量排放SO2或CO2都会导致酸雨的形成 |
| C.采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 |
| D.利用清洁能源如太阳能、潮汐能、风能来发电 |
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL。下列说法正确的是
| A.黑色粉末X是铁粉 |
| B.铜电极连接电源正极 |
| C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O |
D.铜的相对原子质量的计算式是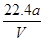 |
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g) + O2(g) = 2H2O(g)△H =–483.6 kJ·mol–1,则氢气的燃烧热为241.8kJ·mol–1 |
| B.已知C(石墨,s) = C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C.已知NaOH(aq) + HCl(aq) =" NaCl(aq)" + H2O(l);△H =–57.4 kJ·mol–1,则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 |
| D.已知:2C(s) + 2O2(g) = 2CO2(g);△H1,2C(s) + O2(g) = 2CO(g);△H2则△H1>△H2 |