实验室需用480 mL 0.1 mol·L-1的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作能配制成功的是( )
| A.称取7.68 g CuSO4粉末,加入500 mL水 |
| B.称取12.5 g CuSO4·5H2O晶体,加水配成500 mL溶液 |
| C.称取8.0 g CuSO4粉末,加入500 mL水 |
| D.称取8.0 g CuSO4·5H2O晶体,加水配成500 mL溶液 |
乙烯的产量是衡量一个国家石油化工生产水平的标志,这是由于乙烯在石油化工生产中具有广泛的用途。下列关于乙烯的用途叙述不正确的是( )
| A.以乙烯为原料可以合成聚乙烯等制备生活用品的材料 |
B.乙烯可以用来制备1,2-二溴乙烷(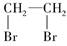 ) ) |
| C.乙烯可以与水发生加成反应制备乙醇(CH3CH2OH) |
D.乙烯可以与HBr发生加成反应制备二溴乙烷(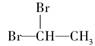 ) ) |
既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的操作方法是( )
| A.混合气通过盛酸性高锰酸钾溶液的洗气瓶 |
| B.混合气通过盛足量溴水的洗气瓶 |
| C.混合气通过盛蒸馏水的洗气瓶 |
| D.混合气跟适量氯化氢混合 |
从台湾向大陆运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是( )
| A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变 |
| B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 |
| C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟 |
| D.利用高锰酸钾溶液的氧化性,催熟水果 |
在光照下,将等物质的量的CH4和Cl2充分反应,得到产物的物质的量最多的是( )
| A.CH3Cl | B.CH2Cl | C.CCl4 | D.HCl |
等物质的量的下列各烃完全燃烧时,消耗氧气最多的是( )
| A.CH4 | B.C2H6 | C.C3H6 | D.C6H6 |