标准状况下,将11.2 L O2、11 g CO2、0.25 mol N2混合,则该混合气体的体积为( )
| A.2.24L | B.22.4 L | C.44.8 L | D.24.5 L |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al + 3O2 + 6H2O = 4Al(OH)3,下列说法不正确的是()
| A.正极反应式为:O2 + 2H2O + 4e- = 4OH- |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需更换铝板就可继续使用 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()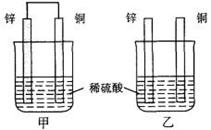
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 | D.产生气泡的速度甲比乙慢 |
下图各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)()
键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。现查得:H-H、Cl-Cl和H-Cl的键能分别为436kJ/mol、243kJ/mol和431kJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应为()
| A.放热91.5kJ | B.放热183kJ | C.吸热183kJ | D.吸热91.5kJ |
航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4  N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是()
N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是()
| A.反应属于分解反应 |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.反应从能量变化上说,主要是化学能转变为热能和动能 |
| D.在反应中高氯酸铵只起氧化剂作用 |