甲醛在一定条件下发生如下反应:2HCHO + NaOH(浓)→ HCOONa + CH3OH,在此反应中,甲醛发生的变化是
| A.仅被氧化 | B.仅被还原 |
| C.既被氧化,又被还原 | D.既未被氧化,也未被还原 |
在恒容条件下N2+3H2 2NH3,表明反应已达到平衡状态的是
2NH3,表明反应已达到平衡状态的是
| A.C(H2)∶C(N2)∶C(NH3)=3∶1∶2 |
| B.压强不变 |
| C.2v(H2)=3v(NH3) |
| D.密度不变 |
已知2SO2+O2 SO3正反应的反应速率是v1,,2HI
SO3正反应的反应速率是v1,,2HI I2+H2,逆反应的反应速率是v2,对于上述两个反应,当增大压强时,v1,v2的变化情况为
I2+H2,逆反应的反应速率是v2,对于上述两个反应,当增大压强时,v1,v2的变化情况为
| A.都减小 | B.都增大 | C.v1减小v2增大 | D.v1增大v2减小 |
1、下列关于苯乙烯(结构简式为 )可以发生的反应是:
)可以发生的反应是:
| A.氧化反应 |
| B.加成反应 |
| C.能与酸性重铬酸钾反应 |
| D.加聚反应 |
E、能使溴水褪色
2、1mol苯乙烯能与mol的H2发生加成反应
已知:CH4+Br2 CH3Br+HBr
CH3Br+HBr
将甲苯和液溴混合在光照下进行反应,得到的产物是:()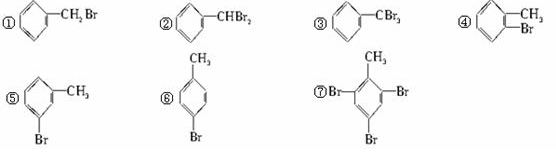
| A.①②③ | B.⑦ | C.④⑤⑥⑦ | D.全部 |
关于离子键、共价键的各种叙述中,下列说法中正确的是
| A.离子键在形成过程中一定有电子的得失 |
| B.非极性键只存在于双原子的单质分子(如O2)中 |
| C.原子序数为11与17的元素能够形成离子化合物,该化合物中存在离子键 |
| D.由不同元素组成的含多个原子的分子里,一定只存在极性键 |