下列说法错误的是
| A.主族元素的原子核外电子最后填入的能级是s能级或p能级 |
| B.BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 |
| C.NH4+和CH4属于等电子体,立体构型都是正四面体 |
| D.向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的Cu(OH)2沉淀 |
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s) 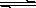 Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
| A.溶液中钙离子数目减小 | B.溶液中钙离子浓度减少 |
| C.溶液中氢氧根离子浓度增大 | D.pH减小 |
在一定温度条件下,对于已达到平衡的反应:
FeCl3 +3KSCN 3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
| A.加入少量氯化钾固体 | B.加入少量氯化铁固体 |
| C.减少Fe(SCN)3的浓度 | D.加水稀释 |
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)= H2O(l)△H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l)△H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+ Q2+Q3 | B.0.5(Q1+Q2+Q3 ) |
| C.0.5 Q1-1.5 Q2+0.5Q3 | D.1.5 Q1-0.5 Q2+0.5Q3 |
下列说法或表示方法正确的是
| A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由“C(石墨)=C(金刚石) ΔH=1.9kJ/mol”可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,若将含1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=—285.8kJ/mol |
下列表述中正确的是
| A.任何能使熵值增大的过程都能自发进行 |
| B.△H<0,△S>0的化学反应一定能自发进行 |
C.已知热化学方程式2SO2(g)+O2(g) 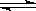 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 |
| D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多 |