有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是( )
| A.Na2SO3已部分被空气中的氧气氧化 |
| B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 |
| C.此实验不能确定Na2SO3是否部分被氧化 |
| D.加硝酸后的不溶沉淀一定是BaSO3 |
在饮用水中添加含钙、镁、锌、硒等的矿物质,可以改善人体营养,增强体质。其中的“钙、镁、锌、硒”是指
| A.分子 | B.原子 | C.离子 | D.元素 |
下列有关原电池的说法正确的是
| A.是把电能转化为化学能的装置 |
| B.负极发生还原反应 |
| C.正极失去电子 |
| D.电流由正极经导线流向负极 |
下列各图中,表示正反应是吸热反应的图是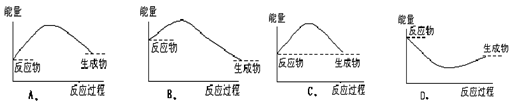
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能
| A.①②④ | B.①③⑤ | C.③⑤ | D.⑤ |
近年来,多地公共汽车大部分采用天然气作为汽车的燃料,其主要目的是
| A.防止石油短缺 | B.降低成本 |
| C.减少对大气的污染 | D.加大发动机的动力 |