能正确表示下列反应的离子方程式是
| A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+=3I2+3H2O |
B.碳酸氢钙溶液和氢氧化钠溶液混合:HCO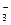 +OH +OH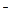 ==CO ==CO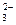 +H2O +H2O |
| C.少量金属钠放入冷水中:Na+ 2H2O="=" Na++2OH—+H2↑ |
D.硫酸铜溶液和氢氧化钡溶液混合: SO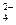 +Ba2+ ="=" BaSO4↓ +Ba2+ ="=" BaSO4↓ |
可逆反应2A(g)+aB(?)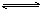 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( ) 
| A.达到平衡后,加入催化剂则C%增大 |
| B.达到平衡后,若升高温度,平衡向右移动 |
| C.a可以为任意的正整数 |
| D.达平衡后,增加B的量,有利于平衡向右移动 |
下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)
| A.图1:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 |
| B.图2:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐 |
| C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物 |
| D.图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
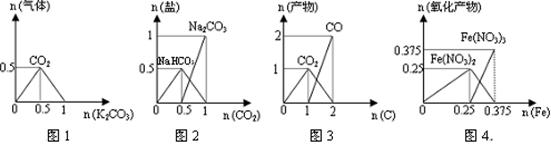
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2—、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是()
| A.原混合溶液中的CO32-与AlO2—的物质的量之比为1:2 |
| B.V1:V2=l:5 |
| C.M点时生成的CO2为0、05mol |
| D.a曲线表示的离子方程式为:AlO2—+H++H2O=Al(OH)3↓ |
下表各组物质中,物质之间不可能实现如图所示转化的是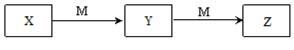
| 选项 |
X |
Y |
Z |
M |
| ① |
Al3+ |
Al(OH)3 |
[Al(OH)4]- |
NaOH |
| ② |
[Al(OH)4]- |
Al(OH)3 |
Al3+ |
HCl |
| ③ |
Fe |
FeCl2 |
FeCl3 |
Cl2 |
| ④ |
Cl2 |
FeCl3 |
FeCl2 |
Fe |
| ⑤ |
NaOH |
Na2CO3 |
NaHCO3 |
CO2 |
| ⑥ |
NH3 |
NO |
NO2 |
O2 |
| ⑦ |
C2H5OH |
CH3CHO |
CH3COOH |
O2 |
| ⑧ |
H2S |
SO2 |
SO3 |
O2 |
A、只有③ B、③④ C、④⑥⑧ D、②③⑦
从矿物学资料查得,一定条件下自然界存在如下反应: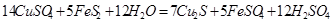 。下列说法正确的是
。下列说法正确的是
A.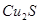 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
B.5 mol  发生反应,有10 mol电子转移 发生反应,有10 mol电子转移 |
C.产物中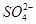 有一部分是氧化产物 有一部分是氧化产物 |
| D.FeS2只作还原剂 |