(8分)下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是 (填写编号)。
(2)能够用以精确量取液体体积的是 (填写编号)。
(3)由于错误操作, 使得到的数据比正确数据偏小的是 (填写编号)。
| A.用量筒量取一定量液体时, 俯视液面读数。 |
| B.中和滴定达终点时俯视滴定管内液面读数。 |
| C.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中。 |
| D.容量瓶刚用蒸馏水洗净,没有烘干。 |
E、定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
F、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用。
G.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度。
(4) 称取10.5g固体样品(1g以下使用游码)时, 将样品放在了天平的右盘, 则所称样品的实际质量为 g。
(1)容量瓶上含有下列量中的(填写字母)
A、压强 B、温度 C、容积 D、密度 E、刻度线
(2)用浓硫酸配制250mL2mol∙L-1硫酸溶液时,所需的玻璃仪器除烧杯、玻璃棒和胶头滴管之外,还需要(填仪器名称);在下列配制过程示意图中,有错误的是(填写序号)。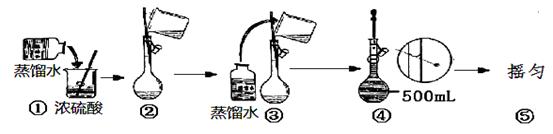
(3)现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试剂瓶后需要贴上标签。请你帮助把下图标签上的内容填上去。
(4)下列情况将使配制溶液的物质的量浓度偏低的有(填序号)
A.容量瓶用蒸馏水洗净后,未待干燥便用来配制
B.NaOH溶解后趁热移入容量瓶中
C.定容时,俯视刻度线
D.摇匀后发现液面未到刻度线,继续加水至刻度线
某化学小组为测定加碘盐中KIO3的质量分数,进行了如下实验。
已知:KIO3 + 5KI + 3H2SO4= 3K2SO4 + 3I2 + 3H2O
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配制溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量的KI溶液;
步骤三:用bmol·L-1 Na2S2O3溶液的溶液滴定步骤二所得溶液至终点,记录数据;再重复滴定2次,平均消耗Na2S2O3溶液的体积为12.00mL。
(1)步骤一中配制250mL溶液,所用到的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还有。
(2)步骤三中进行滴定的过程中下列哪个操作正确,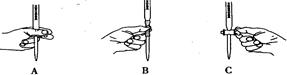
选择作为指示剂,到达滴定终点时的现象为。
(3)实验测得此加碘盐中KIO3的质量分数=(KIO3的相对分子质量为214)。
为测定某铝镁合金中镁的质量分数,某小组计划将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。填写下列空白。
(1)同学们选用甲装置进行实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因是________________。
(2)同学们经讨论认为甲装置有两个方面会引起较大误差,分别是__________和__________。
(3)于是他们设计了实验装置乙。乙中导管a的作用是__________。若实验前后滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为______mL。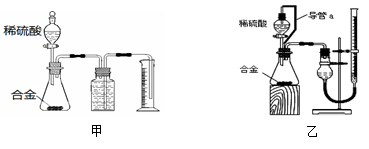
硫酸铜晶体在不同温度下可失去部分或全部结晶水甚至分解成氧化物。某学生在不同温度下给8.000 g硫酸铜晶体加热(温度逐渐升高),实验结果记录如下:
| 实验次序 |
温度(℃) |
冷却后剩余固体的质量(g) |
| 1 |
102 |
6.848 |
| 2 |
113 |
5.696 |
| 3 |
258 |
5.120 |
| 4 |
570 |
2.560 |
(1)第1次实验后,试样晶体失去结晶水的质量是_____ g。
(2)通过计算确定第二次实验后固体物质的化学式为______________。
(3)第四次实验后,剩余固体为一种黑色粉末(假设为纯净物),将该黑色粉末溶解于稀硫酸中,至少需要0.50mol/L的稀硫酸多少毫升?(写出计算过程)
某同学欲配制0.1 mol/LBa(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2试剂。配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
(1)他猜测烧杯中未溶物为BaCO3。理由是_____________;检验方法是_______________。
(2)为准确测定样品中Ba(OH)2的含量。进行如下实验:
①配制250 mL约0.1 mol/L Ba(OH)2溶液:称取5.000 g试样,置于烧杯中,加适量蒸馏水,充分搅拌溶解,静置过滤,得滤液和沉淀,将滤液转入______中,洗涤,定容,摇匀。
②滴定:准确量取25.00 mL所配制Ba(OH)2溶液于锥形瓶中,滴加2滴甲基橙,将0.200 mol/L标准盐酸装入滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐24.20 mL。计算样品中Ba(OH)2的质量分数为____________。
(3)上述滴定中,滴定管在注入标准盐酸之前,先用蒸馏水洗净,再用________________。在滴定中,准确读数应该是滴定管上蓝线的________________处所对应的刻度。滴定终点的现象是_______________。