合成氨反应:3H2+N2  2NH3,其反应速率分别为v(H2)、v(N2)、v(NH3) (用mol·L-1·s-1表示),则正确的关系式是( )
2NH3,其反应速率分别为v(H2)、v(N2)、v(NH3) (用mol·L-1·s-1表示),则正确的关系式是( )
| A.v(H2)=v(N2)=v(NH3) | B.v(N2)=2v(NH3) |
| C.2v(H2)=3v(NH3) | D.v(N2)=3v(H2) |
下列说法错误的是
| A.需要加热方能发生的反应一定是吸热反应 |
| B.放热的反应在常温下不一定容易发生 |
| C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 |
| D.吸热反应在一定的条件下也能发生 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol•L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是:
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
1.0 L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物起始量 |
1.5 mol A 0.5 mol B |
1.5 mol A 0.5 mol B |
6.0 mol A 2.0 mol B |
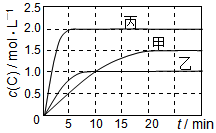
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
不小心使皮肤粘上了高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)稀溶液洗涤,黑斑可迅速褪去,其离子方程式为:MnO4- + H2C2O4+ H+→ CO2 ↑ + Mn2+ + ,下列有关叙述正确的是:
| A.发生还原反应的是:H2C2O4 |
| B.该离子方程式右侧横线上的产物是OH- |
| C.10 mol二氧化碳生成时,电子转移5 mol |
| D.通常用H2SO4 溶液而不用盐酸酸化KMnO4 溶液 |
下列指定反应的离子方程式正确的是:
| A.Fe2O3溶于氢碘酸溶液中:Fe2O3 + 6H+ =2Fe3+ + 3H2O |
| B.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2 + AlO2- + 2H2O=Al(OH)3↓+ CO32- |
| C.NH4HCO3溶于过量的浓KOH溶液:NH4+ + HCO3- + 2OH- =CO32- + NH3↑+ 2H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO4 2-恰好完全沉淀:2Ba2+ + 3OH- + Al3+ + 2SO42- =2BaSO4↓ + Al(OH)3↓ |