下列关于硅元素及其化合物的有关说法正确的是
| A.硅在自然界中既有游离态又有化合态 |
B.SiO2+3C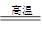 SiC+2CO↑中碳只做还原剂 SiC+2CO↑中碳只做还原剂 |
| C.因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 |
| D.SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 |
从下列实验事实所得出的相应结论不正确的是
若氧元素只有16O、18O两种核素,下列说法正确的是
| A.16O和18O的物理性质和化学性质完全相同 |
| B.通过化学反应可以实现16O与18O的相互转化 |
C.向2SO2(g)+O2(g) 2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 |
| D.用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 |
下列关于有机物结构、性质的说法正确的是
| A.石油的分馏和煤的干馏都是化学变化 |
| B.分子式为C3H7C1的有机物有三种同分异构体 |
| C.甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 |
| D.向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
NA代表阿伏加德罗常数的值。下列有关叙述正确的是
| A.含有NA个氮气和乙烯分子的混合气体质量为28g |
| B.标准状况下,11.2L氦气中含有NA个氦原子 |
| C.将NA个NH3分子溶于lL水中得到lmol/的氨水 |
| D.100mL 0.1mol/LAlCl3溶液含有0.01NA个A13+ |