氯化镁是制取镁的原料之一。现要测定某化工产品(含MgCl2和KCl)中所含的氯化镁质量分数,进行实验:先将10g样品完全溶于水,然后把50g一定质量分数的氢氧化钾溶液平均分五次加入样品溶液中,充分振荡,实验所得数据见下表:
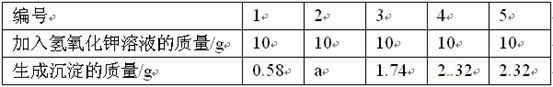
请分析上述数据,回答下列问题:
(1)表中a为。
(2)样品中的氯化钾属于化肥中的肥,可回收利用。
(3)所用的氢氧化钾溶液中溶质的质量分数是。
(4)计算样品中氯化镁的质量分数是多少?(写出计算过程)
科学小组的同学对模拟湿法炼铜实验中得到的铁、铜固体混合物进行含量测定。称取10克固体混合物置于烧杯中,滴加一定质量分数的稀硫酸溶液,记录并绘制了如图所示的曲线。
(1)10克固体混合物中铜的质量为克。
(2)所用稀硫酸溶液溶质的质量分数是多少?(写出计算过程)
电解水实验中,为了增加水的导电性,可在水中加入一定量的稀硫酸.
(1)实验过程中,与电源正极相连的玻璃管内产生的气体是.
(2)某次实验中,将10克10.8%的稀硫酸倒入盛有98克水的烧杯中混合均匀得A溶液,则A溶液中溶质的质量分数为.
(3)将A溶液全部倒入电解水装置,当通电反应到所剩溶液中的含水量为98%时,可制得多少克氢气?
热水瓶用久后,瓶胆内壁常附着一层水垢(主要成份是
和
,其它成份忽略不计).某兴趣小组的同学为了探究水垢中
的含量,取10g水垢样品,向样品中加入足量的稀盐酸,其变化关系如图所示,试计算:
(1)生成二氧化碳的质量为克.
(2)该水垢样品中
的质量分数.(写出解题步骤)
为了测定某纯碱样品中碳酸钠的质量分数,取该样品与足量稀盐酸在烧杯中反应,有关实验数据如下表。
| 反应前 |
反应后 |
||
| 实验数据 |
烧杯和稀盐酸的质量 |
纯碱样品的质量/g |
烧杯和其中混合物的质量/g |
| 120 |
12 |
127.6 |
请计算:(1)该反应生成二氧化碳的质量为g。
(2)该纯碱样品中碳酸钠的质量分数为多少。(请写出计算过程)
某化学探究小组的同学在学校仓库里找到一块废弃的生铁暖气片,其表面有银粉漆(铝粉)涂层.该组同学取一小块生铁暖气片,用砂纸打磨除净涂层,制成生铁样品,为测定此样品中铁质量分数,他们将样品放入烧杯中,再加入足量的稀盐酸,至不再有气泡产生为止.
各步称量数据见下表:(稀盐酸的挥发可忽略不计)
| 除净涂层后的生铁样品质量/ | 11.5 |
| 烧杯的质量/ | 32.5 |
| 所加稀盐酸的质量/ | 200.0 |
| 反应后烧杯及所盛物质的总质量/ | 243.6 |
请回答下列问题:
(1)反应中产生气体的质量是
.
(2)计算该生铁样品中铁的质量分数(写出计算步骤,计算结果精确到0.1%).
(3)以下操作中,对该样品中铁的质量分数的测定结果,没有影响的是(填写序号).
| A. |
加入的稀盐酸不足量 |
B. |
将打磨干净涂层的生铁样品磨成粉末 |
C. |
假设涂层中的铝粉已完全转化为氧化铝,且样品表面涂层未打磨干净. |