食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性: >Fe3+>I2;还原
>Fe3+>I2;还原 性:
性: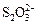 >I-;3I2+6OH-
>I-;3I2+6OH-
 +5I-+3H2O
+5I-+3H2O ; KI+I2
; KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体, 溶液显淡黄色,用CCl4萃取,下层溶液显紫
溶液显淡黄色,用CCl4萃取,下层溶液显紫
红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质的化学式是_________;CCl4中显紫红色的物质的电子式是___________________。
②第二份试液中加入足量KI固体后,反应的离子方程式为_________________________、
______________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________________。
(3)当把KI作为加碘剂的食盐在保存过程中,为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O 3 B.AlCl3 C .NaNO2
3 B.AlCl3 C .NaNO2
(4)对含Fe2+较多的食盐(假 设不含Fe3+),可选用KI作为加碘剂。请设计实验方案检验该加碘盐中的
设不含Fe3+),可选用KI作为加碘剂。请设计实验方案检验该加碘盐中的 Fe2+
Fe2+
实验室可以用MgCl2•6H2O为原料制备碳酸镁晶须,主要流程如下:
试回答:
(1)操作1的名称是_______。
(2)上述反应过程要控制好温度,因为MgCO3置于水中长时间加热煮沸可完全生成Mg(OH)2,其原因是_____________________。
(3)另査阅文献,在加热煮沸时也可能生成碱式碳酸镁Mg5(OH)2(CO3)4·4H2O,写出该反应的化学方程式______________。
(4)某课题组为了确定MgCO3在水中长时间加热煮沸后所得的固体成分,进行如下研究。(注:Mg(OH)2, Mg5(OH)2(CO3)4.4H2O在煮沸时均不会分解)
①定性研究:请你完成下表中内容。
| 实验步骤 |
预期的实验现象和结论 |
| 取一定质量的固体样品 |
若 ,则固体产物为Mg(OH)2 |
②另取一定质量的固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?_______ (填“能”或“否”),理由是______________
亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案:
(1)无色气体B遇空气显红棕色,B的化学式为_______写出甲方案①中反应的离子方程式_______
(2)完成并配平乙方案①中反应的离子方程式
MnO4-+NO2-+=Mn2++NO3-+,
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、_______配制溶液时,定容的操作方法是______
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾溶液(过童)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中NaNO2的质量为_______mg.
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 )
(1)如用如图装置制取氨气,你所选择的试剂是。
制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
(2)发生器用冰水冷却的原因是___________ ___。
(3)液体石蜡鼓泡瓶的作用是_______。
(4)从反应后的混合物中分离出产品的实验方法是_______(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
(5)尾气处理装置如图所示。双通玻璃管的作用:________;浓硫酸的作用:、_______________。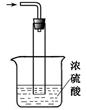
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为
___________。(精确到2位小数)
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
;
(2)装置A中盛有的试剂是,作用是。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是(填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32- 和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-。
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是。
38.现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol/L H2SO4
b.0.01 mol/L KMnO4
c.1 mol/L BaCl2溶液
d.淀粉碘化钾溶液
e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B
两试管中。
步骤二:向A试管中滴加少量___________ (填序号),若溶液_________________(填现象),则假设
1成立。
步骤三:向B试管中滴加少量___________(填序号),若溶液_________________(填现象),则假设2
成立。
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。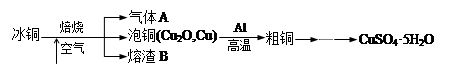
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
|
实验室可用图的装置完成泡铜冶炼粗铜的反应。
