用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S。下列说法正确的是( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.还原剂是S2—,氧化剂是Fe3+ |
| C.氧化产物是S,还原产物是Cu2+和Fe2+ |
| D.当转移1mol电子时,46 g CuFeS2参加反应 |
下列装置能达到对应实验目的的是()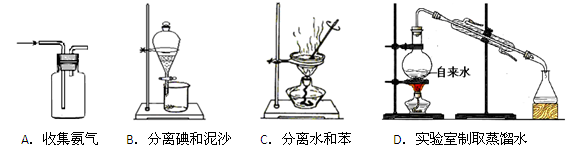
25℃时,0.1mol/L HCl中,下列说法正确的是()
| A.c(H+)×c(OH-)=1×10-14 | B.该溶液中由水电离出的c(H+)= 1×10-7 |
| C.c(H+)=c(OH-)=1×10-7 | D.c(H+)×c(OH-)=1 |
下列各组顺序的排列不正确的是()
| A.酸性:H2SiO3<H2CO3<H3PO4<H2SO4 |
| B.热稳定性:HCl>H2S>PH3>AsH3 |
| C.原子半径:Na<Mg<Al<F |
| D.碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。下列热化学方程式正确的是()
| A.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=+725.8kJ·mol-1 |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-1452kJ·mol-1 |
| C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-725.8kJ·mol-1 |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-22.68kJ·mol-1 |
对于某些离子的检验及结论一定正确的是( )
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |