盐酸、硫酸和硝酸是中学阶段常见的“三大酸”,请就“三大酸”的性质,回答下列问题:
⑴稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为________________________________________________________。
某同学未加入氧化剂,而是 设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
⑵某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下: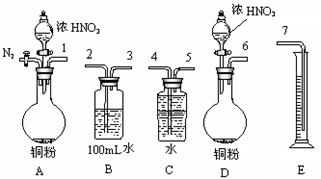
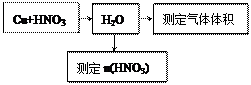 |
①若要测定NO的体积,从上图所示的装置中,你认为应选用 装置进行Cu与浓硝酸反应实验,选用的理由是 。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,需要空气的体积(标准状况)为 L。
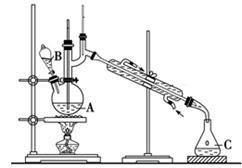
某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下: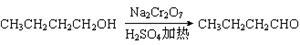
反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
|
| 正丁醇 |
117.2 |
0.810 9 |
微溶 |
| 正丁醛 |
75.7 |
0.801 7 |
微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是 。
(2)加入沸石的作用是 。
(3)分液漏斗使用前必须进行的操作是 。
(4)反应温度应保持在90~95℃,其原因是 。
(5)本实验中,正丁醛的产率为 。
(13分)以下是实验室常用的部分仪器。
请回答下列问题:
(1)序号为⑧和⑩的仪器分别为 、 (填名称、下同)。
(2)能作反应容器且可直接加热的是 。
(3)在分液操作中,必须用到仪器是 (填序号、下同)。
(4)在配制一定物质的量浓度的溶液时,需要上述仪器中的 。
(5)仪器上标有温度的是 。
(6)下图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是________。
a.①是量筒,读数为2.5 mL
b.②是量筒,读数为2.5 mL
c.③是滴定管,读数为2.5 mL
d.②是温度计,读数是2.5 ℃
(7)某同学想用大理石和稀盐酸反应制取少量CO2。教师指出,若用下列装置制取会浪费大量的稀盐酸。于是该同学选用了上述①~⑩中的一种仪器,添加在下列装置中,解决了这个问题。请你将需要添加的仪器画在下图中的合适位置。
己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
回答下列问题:
(1)A中生成氨气反应的化学方程式是 _________________;
(2)B中加入的干燥剂是_______(填序号)①浓硫酸②无水氯化钙③碱石灰;
(3)能证明氨与氧化铜反应的现象:①C中______、②D中有无色液体生成;
设计实验检验D中无色液含有水:取少量液体于试管中,加入少量_______粉末,现象为______。
(4)写出氨气与氧化铜反应的化学方程式 _______________。若收集到2.24L(STP)氮气,计算转移电子数为______________。
下图是实验室中制备气体或验证气体性质的装置图
(1)写出用发生装置A中制取氯气的化学方程式______________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:C12>Fe3+,则装置B中的溶液的作用是______;装置D中加的最佳试剂是(填序号)_________________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的___________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为_________;实验2不严谨之处应如何改进________。
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下: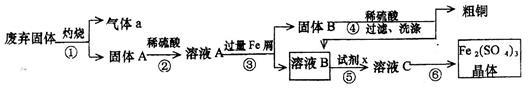
(1)除酒精灯和铁架台(或三脚架)外,①中所需的容器为_____;①和⑥中都用到的玻璃仪器为_______;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式____________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN-被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1硫酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1Fe2(SO4)3;溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证该同学的猜测是否合理。简要说明实验步骤和现象_______。