现有一包只含有氯化钙杂质的粗盐样品。某校化学兴趣小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10
,充分溶解于100
水中(水的密度是
),再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如下图所示。试计算:
(1)该粗盐样品中氯化钙的质量分数。
(2)过滤后所得滤液中溶质的质量分数。(精确到0.1%)

实验室新进一批块状大理石。某化学小组成员称量12.5g该大理石样品,加入足量稀盐酸测定碳酸钙的含量。完全反应后,称得固体剩余的质量为2.5g。样品中杂质不溶于水且不与稀盐酸反应,请回答下列问题:
(1)该样品中碳酸钙的质量为__________。
(2)计算12.5g该样品最多可制得二氧化碳的质量,写出必要的计算过程。
某兴趣小组分别向80.00 g 10%的NaOH溶液中加入体积不同、质量分数相同的盐酸,充分反应后,将所得溶液加热蒸发,直到固体完全析出且没有任何变化后,再研细、烘干、称量;重复将固体烘干、称量,直至称得的固体质量不再发生变化。实验测得,向80.00 g10%的NaOH溶液中加入80.00 mL盐酸时,溶液恰好呈中性,其它测得的部分数据则如下表所示: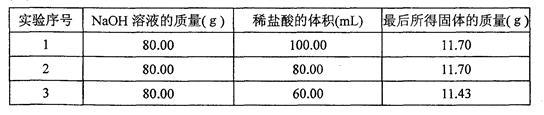
(1)加热蒸发所得溶液时需要用玻璃棒不断搅拌,其目的是: ;
(2)向80.00 g 10%NaOH溶液中加入盐酸的体积为100.00 mL时,最后所得固体的质量仍为11.70 g,其原因是: ,
(3)列式求出向80.00 g 10%NaOH溶液中加入40.00 mL盐酸时,最后所得固体中NaCl的质量分数(小数点后保留两位)。
用溶质的质量分数为36.5%的盐酸20g与足量氢氧化钠溶液恰好完全反应,需要溶质的质量分数为20%的氢氧化钠溶液 g。
欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是_________ 合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,经测定产生了0.4g气体。
请你计算该合金中铜的质量分数。
“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)
| 甲 |
乙 |
丙 |
|
| 烧杯+稀盐酸质量 |
139g |
129g |
129g |
| 加入黄铜样品质量 |
20g |
24g |
20g |
| 充分反应后,烧杯+剩余物质质量 |
158.8g |
152.8g |
148.8g |
请回答下列问题:
(1) 同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是 .
(2)计算黄铜样品中锌的质量分数.