下列说法正确的是
| A.物质的量是一种国际基本物理量 |
| B.标准状况下气体摩尔体积约为22.4L |
| C.1mol氧的质量为16g |
| D.在同温同压下,相同体积的任何气体单质所含原子数相同 |
在密闭容器中进行如下反应:X2(g)+Y2(g) 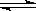 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Z为0.3mol/L | B.Y2为0.4mol/L |
| C.X2为0.2mol/L | D.Z为0.4mol/L |
下列能用勒沙特列原理解释的是
| A.加入催化剂后H2 和O2反应生成水 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
某温度下在固定体积的密闭容器中发生如下反应:2M(g)+N(g)  2E(g),若开始时只充入2molE(g),达到平衡时,混合气体的压强比起时增大了20%;若开始时只充入2molM和1molN的混合气体,达到平衡时M的转化率为
2E(g),若开始时只充入2molE(g),达到平衡时,混合气体的压强比起时增大了20%;若开始时只充入2molM和1molN的混合气体,达到平衡时M的转化率为
| A.20% | B.40% | C.60% | D.80% |
已知热化学方程式:
① C2H2(g) + O2(g) ="=" 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) ="=" 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) ="=" CO2(g)△H2=-393.5 kJ•mol-1
③ H2(g)+ O2(g) ="=" H2O(1)△H3 =" -285.8" kJ·mol-1
则反应④ 2C(s)+ H2(g) ="=" C2H2(g)的△H为
| A.+228.2 kJ·mol-1 | B.-228.2 kJ·mol-1 |
| C.+1301.0 kJ·mol-1 | D.+621.7 kJ·mol-1 |
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0
2Z(g);ΔH<0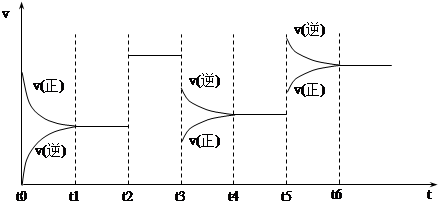
上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率最低 |