下列实验操作中 ,正确的是
,正确的是
| A.稀释浓H2SO4时,将蒸馏水沿容器内壁缓慢倒入浓H2SO中,并及时搅拌 |
| B.测定溶液pH时,用洁净的玻璃棒蘸取待测点在pH试纸上,观察试纸的颜色变化,并与标准比色卡相比较 |
| C.称量NaOH固体时,将NaOH固体放在垫有滤纸的托盘上 |
| D.在蒸发NaCl溶液得到NaCl晶体的实验中,必须待蒸发皿中的水分全部蒸干后再撤去酒精灯 |
在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(气)+B(气)  xC(气),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量:A为0.6 mol;B为0.3 mol;C为1.4 mol,充入容器,达到平衡后,C的体积分数仍为w%,则x值为( )
xC(气),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量:A为0.6 mol;B为0.3 mol;C为1.4 mol,充入容器,达到平衡后,C的体积分数仍为w%,则x值为( )
| A.只能为2 | B.只能为3 | C.可能是2,也可能是3 | D.无法确定 |
铜锌原电池(如图)工作时,下列叙述正确的是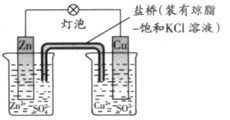
A 正极反应为:Zn—2e-=Zn2+ B电池反应为:Zn+Cu2+=Zn2+ +Cu
C 在外电路中,电流从负极流向正极 D 盐桥中的K+移向ZnSO4溶液
用惰性电极电解100mL饱和食盐水,一段时间后,在阴极得到112mL H2(标准状况),此时电解质溶液(体积变化忽略不计)的pH为 ( )
| A.13 | B.12 | C.8 | D.1 |
反应:L(s)+aG(g) bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
A.a>b上述反应是放热反应
B.a < b上述反应是吸热反应
C.a>b上述反应是吸热反应
D.a < b上述反应是放热反应
下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |