(14分) 在工业生产和日常生活中有重要用途。 I.工业上用钛矿石(
在工业生产和日常生活中有重要用途。 I.工业上用钛矿石( ,含
,含 等杂质)经过下述反应制得:
等杂质)经过下述反应制得:
其中,步骤②发生的反应为: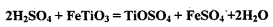
(1)净化钛矿石时,是否需要除去杂质FeO? ______ (填“需要”或“不需要”)。
(2) 净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式: __________________
II. TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Th将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为__________________
“方法二”是先将TiO2与 Cl2、C反应得到TiCl4,再用镁还原得到TL因下述反应难于发生:
所以不能直接由Ti02和Cl2反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(4) 己知:
请写出 与Cl2、C反应制取TiO4的热化学方程式:____________
与Cl2、C反应制取TiO4的热化学方程式:____________
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因________________________________________________
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如下图象。请回答:
(1)分析判断,_____________段化学反应速度最快,原因可能是___________________;
FG段化学反应速率较慢的原因可能是____________________________________________。
(2)为了降低该反应的反应速率,你认为可以采取哪些措施_________________(至少说出两种)。
电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后用FeCl3的溶液与未受保护的铜膜反应以去掉铜,腐蚀后的废液中含有大量的Cu2+。为了回收这一部分Cu2+并制成硫酸铜晶体(CuSO4·5H2O),常用如下步骤:
①向废液中加过量的铁屑,搅拌,静置;②滤出固体物质;③将滤出的固体物质加热煅烧;④把煅烧后的物质放在硫酸中溶解;⑤调节溶液的pH在3.4—4之间,使Fe(OH)3沉淀完全,过滤;⑥浓缩滤液,析出晶体;⑦将过滤得到的晶体溶解,再结晶。
(1)上述③步操作所得煅烧产物成分是_______________。
A.CuO B.CuO和FeO C.CuO和Fe2O3D.CuO和Fe3O4
(2)上述第⑤步操作中,调节溶液的pH宜加入的物质是_______________。
A.氧化铜粉末 B.NaOH溶液 C.稀氨水 D.Na2CO3
(3)上述第⑥步操作中,用浓缩滤液而不用蒸干溶液的主要原因是_______________。
A.蒸干所得到的物质可能含有无水硫酸铜
B.温度升高CuSO4溶解度增大
C.温度升高Cu2+被还原为Cu
D.温度升高CuSO4分解
现给你一试管二氧化氮,其他药品和仪器自选。试设计实验,要求尽可能多地使二氧化氮被水吸收。
| 实验步骤 |
现象 |
解释(可用化学方程式表示) |
|
| (1) |
|||
| (2) |
|||
| (3) |
某学生做钠在氯气中燃烧的实验时,使用了崭新的铜制燃烧匙,当钠燃烧时,除了观察到有白烟外,还有少量棕色的烟,能说明这个现象的化学方程式为
__________________,___________________________;将上述反应得到的固体溶于水后再加入NaOH溶液,产生少量蓝色沉淀,该反应的离子方程式为:
__________________________。
吸烟对健康有害,科学实验表明:香烟所产生的烟雾中至少有300多种化合物对人体有不同的危害。为了鉴定该烟雾中是否存在CO2和CO,将香烟燃烧产物的烟雾进行适当处理后,依次通过足量以下试剂:①澄清石灰水;②浓硫酸;③灼热的黑色氧化铜粉末;④澄清石灰水。发现①④中澄清石灰水变浑浊,其他无明显现象。试完成下列问题:
(1)①中现象说明______________________________________________________________。
(2)烟雾中(填“存在”或“不存在”)CO,作出此判断所依据的实验现象为____________。
(3)③中无明显变化的原因可能是
_________________________________________________。