下列反应中,属于氧化还原反应的是
| A. CaO + H2O = Ca(OH)2 | B. 2KMnO4 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
C. NH4HCO3 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
D.2NaOH+H2SO4==Na2SO4 + 2H2O |
乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说法不正确的是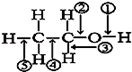
| A.和金属钠作用时,键①断裂 |
| B.和浓硫酸共热至170℃时,键②和⑤断裂 |
| C.和乙酸、浓硫酸共热时,键②断裂 |
| D.在银催化下和氧气反应时,键①和③断裂 |
设NA为阿伏加德罗常数的值,则下列说法正确的是
| A. |
1mol苯酚中“C=C”的个数为3NA |
|
| B. |
2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
|
| C. |
标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为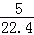 NA NA |
|
| D. |
常温常压下,22.4L丙烷所含有的共价键数目为10NA |
下列各化合物的命名正确的是
| A. |
CH2=CH﹣CH=CH2 1,3﹣二丁烯 |
| B. |
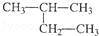 2﹣甲基丁烷 2﹣甲基丁烷 |
| C. |
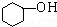 苯酚 苯酚 |
| D. |
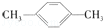 间二甲苯 间二甲苯 |
按官能团分类,下列说法正确的是
A.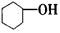 属于芳香化合物 属于芳香化合物 |
B.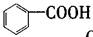 属于羧酸 属于羧酸 |
C.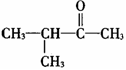 属于醛类 属于醛类 |
D.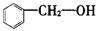 属于酚类 属于酚类 |
下列分子式表示的物质一定是纯净物的是
| A.CH4 | B.C2H6O | C.C6H12O6 | D.C2H4Cl2 |