三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关说法正确的是
| A.反应中NF3是氧化剂,H2O是还原剂 |
| B.反应中被氧化与被还原的原子物质的量之比为2∶1 |
| C.若反应中生成0.2mol HNO3,则反应共转移0.2mol e- |
| D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 |
设NA代表阿伏加德罗常数的数值,下列说法正确的是
A.22.4 L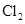 中含有NA个 中含有NA个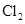 分子 分子 |
| B.标准状况下,22.4L水中的分子数为NA |
C.1 L 0.1 mol·L-1 溶液中有0.1NA个Na+ 溶液中有0.1NA个Na+ |
| D.NA个一氧化碳分子和0.5 mol水的质量比为28 :9 |
下列说法中不正确的是
| A.物质的量是一个物理量,物质的量的单位是摩尔 |
| B.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
| C.摩尔质量、气体摩尔体积、物质的量的浓度的单位分别是g/mol、L/mol、mol / L |
| D.标准状况下,2L二氧化碳和3L一氧化碳所含有的原子数目相等 |
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( )
①过滤②蒸发③溶解④向容量瓶转移液体
| A.①和② | B.①和③ | C.③和④ | D.①和④ |
除去铜粉中混的有少量氧化铜,其主要操作过程是()
| A.在空气中燃烧 | B.加适量稀硫酸、微热、过滤 |
| C.加适量水、微热、过滤 | D.加适量稀硫酸、微热、蒸发 |
下列实验操作和处理方法可能会引发安全事故的是
①将水沿着烧杯内壁缓慢加入浓硫酸中,并用玻璃棒不断搅拌②给试管中的液体加热时,试管口不朝向任何人③夜间厨房发生煤气泄漏时,立即开灯检查煤气泄漏原因,并打开所有门窗通风④用氢气还原氧化铜时,先加热氧化铜,再通入氢气。
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |